
【题目】下列离子方程式正确的是( )
A.氯气通入氯化亚铁溶液中:Cl2+Fe2+=2Cl-+Fe3+
B.钠投入水中:Na+H2O=H2↑+Na++OH-
C.漂白粉的漂白原理:2ClO-+CO2+H2O=CO32-+2HClO
D.用小苏打治疗胃酸过多:HCO3-+H+=H2O+CO2↑
 阶梯计算系列答案
阶梯计算系列答案科目:高中化学 来源: 题型:
【题目】化学与生活息息相关。下列说法正确的是( )
A.A12O3作耐火材料是因为氧化铝熔点高
B.医疗上,碳酸氢钠是治疗胃穿孔的一种药剂
C.铁在潮湿的空气中放置,易发生化学腐蚀而生锈
D.石英、水晶、水泥、光导纤维等物质的主要成分是SiO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组设计实验,用浓硫酸与铜反应制得SO2并进行相关实验探究。
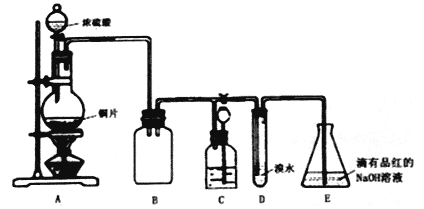
(1)装置A中发生反应的化学方程式是____________,装置B的作用是____________。
(2)设计装置D的目的是验证SO2的_____________性,E中NaOH全部转化为NaHSO3的标志是____________。
(3)装置C的作用是贮存多余的气体,C中应放置的液体是________。
(4)反应结束时烧瓶中Cu有剩余,某同学认为H2SO4也有剩余,他设计了下列实验方案来测定剩余H2SO4的量。经冷却,定量稀释后进行下列实验,能达到目的是________(填序号);
a.用酸碱中和滴定法测定 b.与足量Zn反应,测量生成H2的体积
c.用pH计测溶液pH值 d.与足量BaCl2溶液反应,称量生成沉淀的质量
(5)向E瓶所得NaHSO3溶液中加入漂白粉溶液,反应有三种可能情况:
I. HSO3-与ClO-刚好反应完; II. 漂白粉不足; III. 漂白粉过量
同学们分别取上述混合溶液于试管中,通过下列实验确定该反应属于哪一种情况,请你完成下表:
实验序号 | 实验操作 | 现象 | 反应的可能情况 |
① | 滴加少量淀粉碘化钾溶液,振荡 | III | |
② | 滴加少量棕红色的KI3溶液,振荡 | II | |
③ | 滴入加少量酸性KMnO4溶液,振荡 | 溶液呈紫色 | |
④ | 加入几小块CaCO3固体 | 有气泡产生 |
(6)请设计简单实验证明室温下HSO3-的电离平衡常数Ka与水解平衡常教Kb的相对大小_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)为确定某铝热剂(含氧化铁Fe2O3和铝)的组成,分别进行下列实验。
(1)若取a g样品,向其中加入足量的NaOH溶液,测得生成的气体体积为6.72L(标准状况)。反应的离子方程式是________ _____ ;样品中铝的质量是____ ___g。
(2)若另取a g样品将其加热引燃,恰好完全反应,该反应的化学方程式是________________,则a为________________ g。
(3)待(2)中反应产物冷却后,加入足量盐酸,反应的离子方程式为 和
,同时生成的气体在标准状况体积为 L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列曲线图(纵坐标为沉淀的量,横坐标为加入物质的量)与对应的选项相符合的是( )


A.向1 L浓度均为0.1 mol·L-1的Ba(OH)2、NaAlO2混合溶液中加入0.1 mol·L-1的稀H2SO4
B.向1 L浓度分别为0.1 mol·L-1和0.3 mol·L-1的AlCl3、NH4Cl的混合溶液中加入0.1 mol·L-1的稀NaOH溶液
C.向烧碱溶液中滴加明矾溶液
D.向AlCl3溶液中滴加过量氨水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某汽车安全气囊的产气药剂主要含有NaN3、Fe2O3、KClO4、NaHCO3等物质。当汽车发生碰撞时,产气药剂产生大量气体使气囊迅速膨胀,从而起到保护作用。
(1)NaN3是气体发生剂,受热分解产生N2和Na,N2的结构式为 。
(2)Fe2O3是主氧化剂,与Na反应生成的还原产物为 (已知该反应为置换反应),Fe2O3还可用于“铝热法”炼铁,铝热反应在冶金工业上可用于 。
(3)KClO4是助氧化剂,反应过程中与Na作用生成KCl和Na2O,Na2O的电子式为 。
(4)NaHCO3是冷却剂,吸收产气过程中释放的热量而发生分解,其化学方程式为:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、W是短周期界素中的四种非金属元素,它们的原子序数依次增大,X元素的原子形成的离子就是一个质子,Z、W在元素周期表中处于相邻的位置, 它们的单质在常温下均为无色气体,Y原子的最外层电子数是内层电子数的2倍。
(1)请写出Z在元素周期表中的位置为第 周期、第 族。
(2)气体分子YW2的电子式为 。
(3)由X、Y、Z、W四种元素可组成酸式盐,该化合物的水溶液与足量NaOH溶液在加热条件下反应的离子方程式为 。
(4)在一定条件下,由X单质与单质Z可化合生成E,工业上用E检验输送氯气的管道是否漏气,可观察到大量白烟,同时有单质Z生成,写出化学方程式 。该反应中被氧化的E与参与反应的E的质量之比 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【无机工业流程】

实验室从含碘废液(除H2O外,含有CCl4、I2、I- 等)中回收碘,其实验过程如下:
(1)向含碘废液中加入稍过量的Na2SO3溶液,将废液中的I2还原为I-,其离子方程为 ;该操作将I2还原为I- 的目的是 。
(2)操作X的名称为____________。

(3)氧化时,在三颈烧瓶中将含I-的水溶液用盐酸调至pH约为2,缓慢通入Cl2,在40 ℃左右反应(实验装置如图所示)。实验控制在较低温度下进行的原因是 ;锥形瓶里盛放的溶液为 。
(4)已知:5SO![]() +2IO
+2IO![]() +2H+===I2+5SO
+2H+===I2+5SO![]() +H2O,某含碘废水(pH约为8)中一定存在I2,可能存在I-、IO
+H2O,某含碘废水(pH约为8)中一定存在I2,可能存在I-、IO![]() 中的一种或两种。请补充完整检验含碘废水中是否含有I-、IO
中的一种或两种。请补充完整检验含碘废水中是否含有I-、IO![]() 的实验方案:取适量含碘废水用CCl4多次萃取、分液直到水层用淀粉溶液检验不出有碘单质存在;____________________
的实验方案:取适量含碘废水用CCl4多次萃取、分液直到水层用淀粉溶液检验不出有碘单质存在;____________________
实验中可供选择的试剂:稀盐酸、淀粉溶液、FeCl3溶液、Na2SO3溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与人类的生活息息相关,下列有关说法正确的是( )
A.因铝表面能形成致密的氧化膜,所以铝制餐具可以长期使用
B.因废弃物易污染环境,腈纶不宜大量取代棉、麻等天然材料
C.SiO2用途广泛,因其高熔点的特性成为光导纤维的主要原料
D.有机玻璃(聚甲基丙烯酸甲酯)是通过缩聚反应制得的
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com