
��8�֣�����ԭ��ص�֪ʶ�ش���������
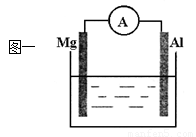
��1��ͼһ�ձ�����ҺΪϡ���ᣬ��۲쵽Al�ϵ�������
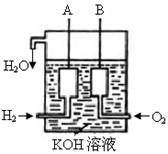
��2����������������ɴ���ʹ����һ������װ�ã��乹����ͼ��ʾ��A��B�����缫���ɶ��̼����ɡ��õ�ص�������ӦΪ�� ��
��3�����������װ����ͨ���H2�ij�CH4���壬Ҳ�������һ��ԭ�� ��װ�ã���ص��ܷ�Ӧ����ʽΪ��CH4+2O2+2KOH=K2CO3+3H2O����õ�صĸ�����ӦʽΪ�� ��
��4��Ǧ���طŵ�ʱ��Ӧ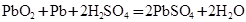 �����ŵ�����2mol����ʱ��·��ת�Ƶ���_________mol
�����ŵ�����2mol����ʱ��·��ת�Ƶ���_________mol
��1�������������� ��2��O2+2H2O+4e��=4OH��
��3��CH4+10OH����8e����CO32��+7H2O ��4��2mol (1��)
����������1����ԭ����нϻ��õĽ����������������õĽ������ǽ���������������Ϊþ�Ļ�����ǿ��Al�ģ���������ϡ�������������Һ����þ�Ǹ�����������������Һ�е��������������ϵõ����ӣ�����ԭ����������
��2����ȼ�ϵ���У������õ����ӣ�����������ȼ���ڸ���ͨ�룬�������������������ͨ�룬���������ӦʽΪO2+2H2O+4e��=4OH����
��3�������ڷ�Ӧ��ʧȥ���ӣ�����������CO2��ˮ���������������������Һ���������ɵ�CO2�����գ�����̼��ء����Ը����ĵ缫��ӦʽΪCH4+10OH����8e����CO32��+7H2O��
��4�������ܷ�Ӧʽ���жϣ�Ǧ�ǻ�ԭ�������ϼ���0�����ߵ���2�ۣ�ʧȥ2�����ӣ�����ÿ����2mol���ᣬ��Ӧ��ת�Ƶĵ�����2mol��


 ��ĩ�����ϵ�д�
��ĩ�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| �Ȼ�����Һ���� | 10�� | 20�� | 30�� | 2mL | 3mL | 4mL |
| ��ȡ���ϲ���Һ��ɫ | ��ɫ | ��ɫ | ��ɫ | �����ɫ | ��ɫ�Դ���ɫ | �ƺ�ɫ |
| ����KSCN��Һ����ɫ | ����� | ����� | �Ա�� | ƫѪ��ɫ | Ѫ��ɫ | Ѫ��ɫ |
| c��I-��/mol?L-1 | c��Fe3+��/mol?L-1 | v/mol?L-1?s-1 | |
| �� | 0.20 | 0.80 | 0.032k |
| �� | 0.60 | 0.40 | 0.144k |
| �� | 0.80 | 0.20 | 0.128k |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��8�֣�����ԭ��ص�֪ʶ�ش���������
��1��ͼһ�ձ�����ҺΪϡ���ᣬ��۲쵽Al�ϵ�������
��2����������������ɴ���ʹ����һ������װ�ã��乹����ͼ��ʾ��A��B�����缫���ɶ��̼����ɡ��õ�ص�������ӦΪ�� ��
��3�����������װ����ͨ���H2�ij�CH4���壬Ҳ�������һ��ԭ�� ��װ�ã���ص��ܷ�Ӧ����ʽΪ��CH4+2O2+2KOH=K2CO3+3H2O����õ�صĸ�����ӦʽΪ�� ��
��4��Ǧ���طŵ�ʱ��Ӧ![]() �����ŵ�����2mol����ʱ��·��ת�Ƶ���_________mol
�����ŵ�����2mol����ʱ��·��ת�Ƶ���_________mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012-2013ѧ��ӱ�ʡ����һ�и߶���ѧ����ĩ���Ի�ѧ�Ծ����������� ���ͣ������
������ѧ֪ʶ������������⣺
��1����ѧ��Ӧ����Ϊ�ɼ����Ѻ��¼����ɵĹ��̡��������γɣ����1 mol��ѧ��ʱ�ͷţ������գ�����������֪������ȼ�ղ���P4O6�ķ��ӽṹ��ͼ��ʾ�����ṩ���¼��ܣ�kJ�� mol-1���� P��P��198�� P��O��360�� O��O��498������(P4)ȼ�յ��Ȼ�ѧ����ʽΪ ��
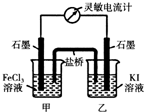
��2����ѧ�������֮������ת������Fe��Cu��C(ʯī)��CuSO4��Һ��FeSO4��Һ��Fe2(SO4)3��Һ ��AgNO3��ҺΪԭ�ϣ�ͨ��ԭ��ط�Ӧʵ��2Fe3+ + Cu��2Fe2+ + Cu2+,�������ͼ����������ʹ֮�γɱպϻ�·������Ԫ�ط��ű����缫���׳��е��Һ�� ��Һ���ҳ��е��Һ�� ��Һ����Ҫ�ס��������е����Ԫ������ʼ�ձ��ֲ��䣩
��3��ij�жԴ������м�⣬���ָ�����Ҫ��Ⱦ��Ϊ�����������PM2.5��ֱ��С�ڵ���2.5��m���������������Ҫ��ԴΪȼú��������β���ȡ���ˣ���PM2.5��SO2��NOx�Ƚ����о�������Ҫ���塣��ش��������⣺
�ٶ�PM2.5��������������ˮ�������Ƴɴ�������������ø���������ˮ���������ӵĻ�ѧ��ּ���ƽ��Ũ�����±���
| ���� | K+ | Na+ | NH4+ | SO4���� | NO3�� | Cl�� |
| Ũ��/ mol?L-1 | 4��10-6 | 6��10-6 | 2��10-5 | 4��10-5 | 3��10-5 | 2��10-5 |
 2NO(g)
2NO(g) 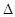 H��0
H��0�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2011-2012ѧ�����ʡ����һ�и�һ��ѧ�����п��Ի�ѧ�Ծ����������� ���ͣ������
��8�֣�����ԭ��ص�֪ʶ�ش���������
��1��ͼһ�ձ�����ҺΪϡ���ᣬ��۲쵽Al�ϵ������� 
��2����������������ɴ���ʹ����һ������װ�ã��乹����ͼ��ʾ��A��B�����缫���ɶ��̼����ɡ��õ�ص�������ӦΪ�� ��
��3�����������װ����ͨ���H2�ij�CH4���壬Ҳ�������һ��ԭ�� ��װ�ã���ص��ܷ�Ӧ����ʽΪ��CH4+2O2+2KOH=K2CO3+3H2O����õ�صĸ�����ӦʽΪ�� ��
��4��Ǧ���طŵ�ʱ��Ӧ �����ŵ�����2mol����ʱ��·��ת�Ƶ���_________mol
�����ŵ�����2mol����ʱ��·��ת�Ƶ���_________mol
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com