
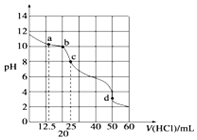
 在常温下,0.10mol•L-1Na2CO3溶液25mL 用0.10mol•L-1盐酸滴定,其滴定曲线如图.对滴定过程中所得溶液中相关离子浓度间的关系,下列有关说法正确的是( )
在常温下,0.10mol•L-1Na2CO3溶液25mL 用0.10mol•L-1盐酸滴定,其滴定曲线如图.对滴定过程中所得溶液中相关离子浓度间的关系,下列有关说法正确的是( )| A. | a点:c(CO32-)=c(HCO-3)>c(OH-) | B. | b点:5c(Cl-)>4c(HCO-3)+4c(CO2-3) | ||
| C. | c点:c(OH-)=c(H+)+c(HCO-3)+2c(H2CO3) | D. | d点:c(H+)=c(CO2-3)+c(HCO-3)+c(OH-) |
分析 A.a点时n(HCl)=0.1mol/L×0.0125L=0.00125mol,反应生成0.00125molNaHCO3,剩余0.00125molNa2CO3,从盐类的水解程度的角度分析;
B.溶液中存在物料守恒,从物料守恒的角度分析;
C.c点时n(HCl)=0.1mol/L×0.025L=0.0025mol,恰好完全反应生成NaHCO3;
D.溶液中满足电荷守恒,根据电荷守恒的角度分析.
解答 解:A.a点时n(HCl)=0.1mol/L×0.0125L=0.00125mol,反应生成0.00125molNaHCO3,剩余0.00125molNa2CO3,由于水解程度大于电离程度,则c(HCO3-)>c(CO32-),故A错误;
B.b点时n(HCl)=0.1mol/L×0.02L=0.002mol,由物料守恒可知:5c(Cl-)=4c(HCO3-)+4c(CO32-)+4c(H2CO3),则5c(Cl-)>4c(HCO3-)+4c(CO32-),故B正确;
C.c点时n(HCl)=0.1mol/L×0.025L=0.0025mol,恰好完全反应生成NaHCO3,由于HCO3-水解程度较弱,则有c(HCO3-)>c(OH-),故C错误;
D.d点时加入盐酸0.005mol,溶液中溶由反应生成的CO2,溶液存在电荷守恒,存在c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-)+c(Cl-),由于c(Na+)=c(Cl-),则 c(H+)=c(HCO3-)+2c(CO32-)+c(OH-),故D错误;
故选B.
点评 本题综合考查离子浓度的大小比较,题目难度较大,本题注意分析反应物的物质的量之间的关系,判断反应的程度以及溶液的主要成分,结合盐类水解的原理解答.


科目:高中化学 来源: 题型:解答题
| 反应速率v | 平衡常数K | 平衡转化率α |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L0.1mol•L-1NaHS溶液中,S2-与HS-数目之和为0.1NA | |
| B. | 标准状况下,22.4LSO3含有NA个SO3分子 | |
| C. | 4gD2O与4gH218O含有的中子数均为2NA | |
| D. | 常温下,56g铁片投入足量浓H2SO4中生成NA个SO2分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 非金属性:Y>X>W | |
| B. | Z与W形成的化合物中存在共价键 | |
| C. | 一定条件下Z3Y2与水反应可生成M | |
| D. | 工业上用W单质与澄清石灰水反应制取漂白粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②③④ | C. | ①③④ | D. | ①②③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com