
| A. | 密闭容器中9.6克硫粉与11.2克铁粉混合加热生成硫化亚铁17.6克时放出19.12 kJ热量,则Fe(S)+S(S)=FeS(S)△H=-95.6 kJ•mol-1 | |
| B. | 稀醋酸和0.1mol/L的氢氧化钠溶液反应,H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ/mol | |
| C. | 已知1 mol氢气完全燃烧生成液态水所放出的热量为285.5 kJ,则水分解的热化学方程式:2H2O(l)=2H2(g)+O2(g)△H=+285.5kJ/mol | |
| D. | 已知2C(s)+O2(g)=2CO(g)△H=-221 kJ/mol,则可知C的燃烧热△H=-110.5 kJ/mol |
分析 A.生成硫化亚铁17.6 g即0.2mol时,放出19.12 kJ热量,注意物质的状态即可写出热化学方程式;
B.醋酸是弱酸存在电离平衡,电离过程是吸热过程;
C.反应的焓变和化学方程式中物质的量有关;
D.依据燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量分析.
解答 解:A.密闭容器中,9.6g硫粉物质的量为0.3mol,与11.2g铁粉物质的量为0.2mol混合加热生成硫化亚铁17.6g时,硫过量,放出19.12kJ热量,所以1mol铁反应放热=19.12KJ×$\frac{1}{0.2}$=95.6KJ,热化学方程式为Fe(s)+S(s)═FeS(s)△H=-95.6kJ.mol-1 ,故A正确;
B.稀醋酸是弱酸电离过程是吸热过程,与0.1mol•L-1NaOH溶液反应放出的热量小于中和热,焓变是负值则:H+(aq)+OH-(aq)═H2O(l)△H>-57.3kJ•mol-1,故B错误;
C.已知1mol氢气完全燃烧生成液态水所放出的热量为285.5kJ,则水分解的热化学方程式:2H2O(l)═2H2(g)+O2(g)△H=+571kJ.mol-1,故C错误;
D.燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,碳燃烧生成的一氧化碳不是稳定氧化物,故D错误;
故选A.
点评 本题综合考查热化学方程式的书写,为高频考点,侧重考查中和热、燃烧热和反应热数值的计算,注意把握中和热和燃烧热的定义要点,难度不大.


科目:高中化学 来源: 题型:解答题
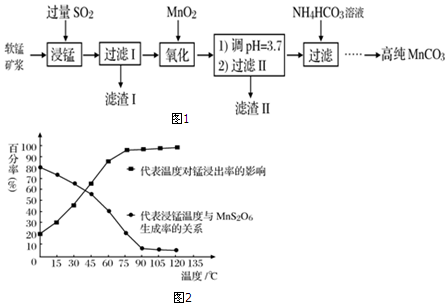
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 25℃ | pH | 25℃ | pH |
| 饱和H2S溶液 | 3.9 | FeS开始沉淀 | 3.0 |
| SnS沉淀完全 | 1.5 | FeS沉淀完全 | 5.5 |
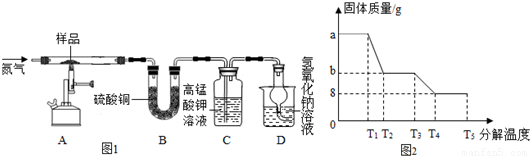
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-═CaSO3↓+2HClO | |
| B. | Fe(NO3)3溶液中加人过量的HI溶液2Fe3++2I-═2Fe2++I2 | |
| C. | NaNO2溶液中加入酸性KMnO4溶液:2MnO4-+5NO2-+6H+═2Mn2++5NO3-+3H2O | |
| D. | NaHCO3溶液中加入过量的Ba(OH)2溶液:2HCO3-+Ba-+2BaCO3↓+2HO+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2165 kJ•mol-1 | B. | 2033 kJ•mol-1 | C. | 406.6 kJ•mol-1 | D. | 2077 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com