
| A. | ①④②③⑤ | B. | ④①②③⑤ | C. | ⑤③②①④ | D. | ④①③⑤② |
 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案科目:高中化学 来源: 题型:多选题
| A. | 14 | B. | 15 | C. | 16 | D. | 17 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
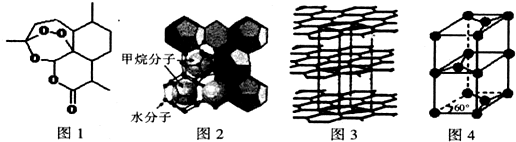
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
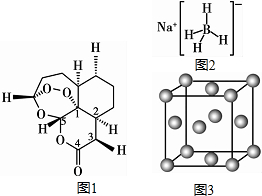 现有H、C、B、0、N、Na、Cu等七种元素,可形成多种物质.2015年10月中国药学家屠呦呦因发现青蒿素(含H、C、O元素)而获得诺贝尔生理医学奖,青蒿素( C15H22O5)的结构
现有H、C、B、0、N、Na、Cu等七种元素,可形成多种物质.2015年10月中国药学家屠呦呦因发现青蒿素(含H、C、O元素)而获得诺贝尔生理医学奖,青蒿素( C15H22O5)的结构查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Li和Na | B. | Rb和Ca | C. | Na和Cu | D. | K和Na |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验 | 解释或结论 |
| A | 向某溶液中加入NaOH并微热,产生能使湿润的红色石蕊试纸变蓝的气体 | 原溶液中一定存在NH4+ |
| B | 铜粉不能溶于冷的浓硫酸 | 铜在冷的浓硫酸中发生钝化 |
| C | 往溴水中通入SO2,溶液褪色 | SO2具有还原性 |
| D | 向FeCl2溶液中通入Cl2,溶液由浅绿色变为黄色 | Cl2的氧化性比FeCl3的强 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 科学家通过X射线推测胆矾中既含有配位键,又含有氢键,其结构示意图可简单表示如下,其中配位键和氢键均采用虚线表示.
科学家通过X射线推测胆矾中既含有配位键,又含有氢键,其结构示意图可简单表示如下,其中配位键和氢键均采用虚线表示. .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 甲烷的球棍模型: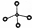 | |
| B. | 乙炔的结构简式:CH=CH | |
| C. | 3-甲基-1-丁烯的结构简式:(CH3)2CHCH=CH2 | |
| D. | 羟基的电子式: |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com