
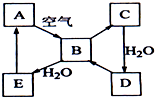
 如图表示淡黄色固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去).化合物B在常温常压下为气体,B和C的相对分子质量之比为4:5,化合物D是重要的工业原料.
如图表示淡黄色固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去).化合物B在常温常压下为气体,B和C的相对分子质量之比为4:5,化合物D是重要的工业原料.分析 A为淡黄色固体单质,应为S,由转化关系可知B为SO2,C为SO3,它们的相对分子质量为64:80=4:5,恰好与题意相符,则D为H2SO4,它是一种重要的工业原料,与题意也相符,SO2和水反应生成E为H2SO3,结合物质的性质以及题目要求可解答该题.
解答 解:A为淡黄色固体单质,应为S,由转化关系可知B为SO2,C为SO3,它们的相对分子质量为64:80=4:5,恰好与题意相符,则D为H2SO4,它是一种重要的工业原料,与题意也相符,SO2和水反应生成E为H2SO3,
(1)A为S,可与氢气反应生成硫化氢,反应的方程式为H2+S$\frac{\underline{\;\;△\;\;}}{\;}$H2S,故答案为:H2+S$\frac{\underline{\;\;△\;\;}}{\;}$H2S;
(2)H2SO3与H2S反应生成S,反应的方程式为H2SO3+2H2S═3S↓+3H2O,故答案为:H2SO3+2H2S═3S↓+3H2O;
(3)浓硫酸可与C、Cu等还原性物质在加热的条件下反应生成SO2,反应的方程式可为C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O或Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O等,
故答案为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O或Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O等;
(4)将5mL 0.10mol•L-1的H2SO3溶液与10mL 0.10mol•L-1的NaOH溶液混合,二者恰好反应,反应的离子方程式为H2SO3+2OH-═SO32-+2H2O,
故答案为:H2SO3+2OH-═SO32-+2H2O;
(5)E为H2SO3在空气中容易变质而生成D为H2SO4,反应的化学方程式为:2H2SO3 +O2=2H2SO4,硫酸为强酸,溶液pH变小,故答案为:变小;2H2SO3 +O2=2H2SO4.
点评 本题考查无机物的推断,为高频考点,侧重学生的分析能力的考查,注意淡黄色固体单质为该题的突破口进行推断,注意把握物质的化学性质,能熟练书写反应的化学方程式.


 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案科目:高中化学 来源: 题型:解答题

| 编号 | Ⅰ | Ⅱ | Ⅲ |
| a | 干燥的有色布条 | 碱石灰 | 湿润的有色布条 |
| b | 干燥的有色布条 | 无水硫酸铜 | 湿润的有色布条 |
| c | 湿润的有色布条 | 浓硫酸 | 干燥的有色布条 |
| d | 湿润的有色布条 | 无水氯化钙 | 干燥的有色布条 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ⑩ | ② | ③ | ||||
| 三 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
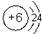 ,元素⑩的单质与氢气反应的化学方程式为N2+3H2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$2NH3.
,元素⑩的单质与氢气反应的化学方程式为N2+3H2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$2NH3.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  | B. |  | C. |  | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
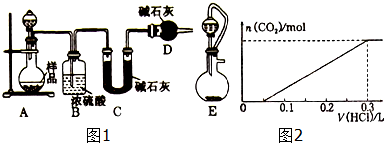
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
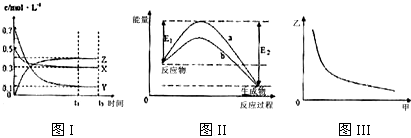
| A. | 该反应热化学方程式为X(g)+3Y(g)?2Z(g)△H=-(E2-E1)kJ•mol-1 | |
| B. | 若图III中甲表示压强,乙表示Z的含量,则其变化符合图III中曲线 | |
| C. | 该温度下,反应的平衡常数数值约为533.若升高温度,该反应的平衡常数减小,Y的转化率降低 | |
| D. | 图II中曲线a是加入催化剂时的能量变化曲线,曲线b是没有加入催化剂时的能量变化曲线 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑤ | B. | ①④⑤⑥ | C. | ②③⑤⑥ | D. | ①③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若Va=Vb,则混合后溶液PH=7 | |
| B. | 若Va<Vb,则混合后溶液PH一定大于7 | |
| C. | 若Va=Vb,则CH3COOH与NaOH完全中和 | |
| D. | 若Va=Vb,混合的溶液中微粒浓度关系可能为c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com