
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:W<Y<Z | |
| B. | 简单气态氢化物的热稳定性:Z>Y>W | |
| C. | W、X能形成两种化合物,其中一种与水反应生成气体 | |
| D. | 四种元素中,Z的最高价氧化物对应的水化物酸性最强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳氢化合物的通式为CnH2n+2 | |
| B. | 燃烧产物为CO2和H2O的化合物一定是碳氢化合物 | |
| C. | 碳原子间以单键相连的烃是烷烃 | |
| D. | 烷烃分子的相对分子质量一定是偶数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
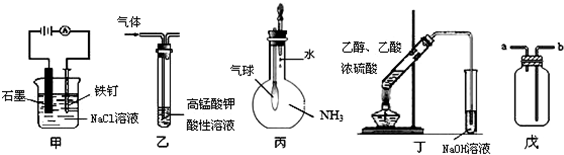
| A. | 只有③④ | B. | 只有③⑤ | C. | 只有①③⑤ | D. | 只有①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 摩尔表示物质的质量的单位 | B. | 16gO2含有0.5mol O2分子 | ||
| C. | 2gH2的体积约为22.4L | D. | 物质的摩尔质量等于其式量 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
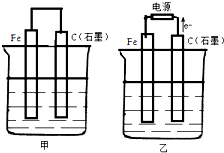 如图甲、乙是电化学实验装置.
如图甲、乙是电化学实验装置.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素编号 | 元素性质或原子结构 |
| B | 短周期主族元素中原子半径最大 |
| C | 单质为双原子分子,是空气的主要成分,化学性质稳定 |
| D | 元素最高正价是+7价 |
| E | M层上有6个电子 |
 ;元素E与元素D相比,非金属性较强的是Cl(用元素符号表示),下列实验能证明这一事实的是B(填序号).
;元素E与元素D相比,非金属性较强的是Cl(用元素符号表示),下列实验能证明这一事实的是B(填序号).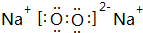 ,其中含有离子、非极性键(填“离子”、“极性”或“非极性”);该化合物加入FeCl2溶液中,产生红褐色沉淀,但无气体产生,试写出该反应的离子方程式3Na2O2+6Fe2++6 H2O=4Fe(OH)3+2Fe3++6Na+.
,其中含有离子、非极性键(填“离子”、“极性”或“非极性”);该化合物加入FeCl2溶液中,产生红褐色沉淀,但无气体产生,试写出该反应的离子方程式3Na2O2+6Fe2++6 H2O=4Fe(OH)3+2Fe3++6Na+.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com