
| A. | 稳定性:H2S>HF | B. | HCl的电子式为 | ||
| C. | H2O的摩尔质量为18 | D. | 在卤化氢中HI最稳定 |
分析 A.元素的非金属性越强,对应的氢化物越稳定;
B.HCl为共价化合物,组成原子最外层满足稳定结构;
C.H2O的相对分子质量为18,摩尔质量为18g/mol;
D.卤化氢中HF最稳定.
解答 解:A.非金属性:F>S,元素的非金属性越强,对应的氢化物越稳定,则稳定性:H2S<HF,故A错误;
B.HCl为共价化合物,组成原子最外层满足稳定结构,电子式为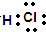 ,故B正确;
,故B正确;
C.H2O的相对分子质量为18,摩尔质量为18g/mol,故C错误;
D.卤族元素的非金属性F>Cl>Br>I,F的非金属性最强,则卤化氢中HF最稳定,故D错误.
故选B.
点评 本题考查较为综合,题目难度不大,学习中注意把握电子式的书写方法和元素周期律的递变规律.


科目:高中化学 来源: 题型:解答题

| 开始沉淀的pH | 沉淀完全的pH | |
| Al3+ | 3.2 | 4.4 |
| Fe2+ | 6.3 | 8.4 |
| Ca2+ | 11.8 | \ |
| Mg2+ | 8.8 | 10.8 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤ | B. | ②④⑤ | C. | ①②③⑤ | D. | ③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 制取NaHCO3的反应是利用其溶解度最小 | |
| B. | 用澄清的石灰水可鉴别NaHCO3和Na2CO3 | |
| C. | 在第③、④、⑤步骤中,溴元素均被氧化 | |
| D. | 工业上通过电解饱和MgCl2溶液制取金属镁 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{24}^{52}$Cr | B. | ${\;}_{12}^{24}$Mg | C. | ${\;}_{26}^{56}$Fe | D. | ${\;}_{22}^{48}$Ti |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氢氧燃料电池已用于航天飞机.如图为氢氧燃料电池构造示意图,其中A、B为气体进口,C1、C2均为石墨电极,电解质溶液为30%的氢氧化钾溶液.
氢氧燃料电池已用于航天飞机.如图为氢氧燃料电池构造示意图,其中A、B为气体进口,C1、C2均为石墨电极,电解质溶液为30%的氢氧化钾溶液.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解质溶液中电子向正极移动 | |
| B. | 放电一段时间后,KOH的物质的量浓度不变 | |
| C. | 通乙烷的电极为负极 | |
| D. | 参加反应的O2和C2H6的物质的量之比为2:7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 共价键 | H-H | F-F | H-F | H-Cl | H-I |
| E(kJ•mol -1 ) | 436 | 157 | 568 | 432 | 298[ |
| A. | H2(g)+F2(g)═2HF(g)△H=-25 kJ•mol -1 | |
| B. | 表中最稳定的共价键是H-F键 | |
| C. | H 2(g)→2H(g)△H=+436 kJ•mol -1 | |
| D. | 432 kJ•mol -1>E(H-Br)>298 kJ•mol -1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | V(A)=0.15 mol•L-1•S-1 | B. | V(B)=0.3 mol•L-1•S-1 | ||
| C. | V(C)=0.4 mol•L-1•S-1 | D. | V(D)=0.45 mol•L-1•S-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com