
| A£®ŌŚĒāŃõ»Æ±µČÜŅŗÖŠÖšµĪ¼ÓČėĮņĖįĒāÄĘČÜŅŗÖĮĒ”ŗĆ³ŹÖŠŠŌ£ŗ Ba2++2OH-+2H++SO42-====BaSO4”ż+2H2O |
| B£®ŌŚ±½·ÓÄĘČÜŅŗÖŠĶØČėÉŁĮ涞Ńõ»ÆĢ¼£ŗC6H5O-+H2O+CO2”śC6H5OH+HCO3- |
| C£®ŌŚ³ĪĒåŹÆ»ŅĖ®ÖŠµĪ¼Ó¹żĮæĢ¼ĖįĒāÄĘČÜŅŗ£ŗ Ca2++2HCO3-+2OH-====CaCO3”ż+2H2O+ CO32- |
| D£®Ļņ100mL0.2mol/Läå»ÆŃĒĢśµÄČÜŅŗÖŠĀżĀżĶØČė448mL£Ø±ź×¼×“æö£©Cl2£ŗ |

| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®NaHSO4 =Na£«£«HSO4£ | B£®H2SO3 2H£«£«SO32£ 2H£«£«SO32£ |
C£®Fe(OH)3 Fe3+ £«3OH£ Fe3+ £«3OH£ | D£®CaCO3  Ca2+£«CO32£ Ca2+£«CO32£ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®H2SO4ČÜŅŗŗĶBa(OH)2ČÜŅŗ»ģŗĻ£ŗ Ba2+ + OH- + H+ + SO42£="=" BaSO4”ż+ H2O |
| B£®ĀĮ·Ū¼ÓČėµ½NaOHČÜŅŗÖŠ£ŗ2Al + 2OH-+ 2H2O == 2AlO2-+ 3H2”ü |
| C£®ŹµŃéŹŅÓĆŹÆ»ŅŹÆÖʶžŃõ»ÆĢ¼ĘųĢå£ŗCO32- + 2H+== CO2”ü+ H2O |
| D£®ÄĘæéĶ¶Čėµ½CuSO4ČÜŅŗÖŠ£ŗ2Na+Cu2+==2Na++Cu |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®±½·ÓÄĘČÜŅŗÓėÉŁĮæµÄCO2·“Ó¦£ŗ C6H5O£+CO2+H2O ”ś C6H5OH+CO32 £ |
| B£®½«±ź×¼×“æöĻĀ1£®12 LĀČĘųĶØČė10 mL 1 mol / LµÄäå»ÆŃĒĢśČÜŅŗÖŠ£ŗ 2Fe2£«£«4Br££«3Cl2£½2Fe3£«£«6Cl££«2Br2 |
| C£®ĻņNaOHČÜŅŗÖŠµĪ¼ÓĶ¬ÅØ¶ČµÄÉŁĮæCa(HCO3)2ČÜŅŗ£ŗCa2++ HCO3- +OH-£½CaCO3”ż+H2O |
| D£®NH4HSO4ČÜŅŗÖŠ¼ÓČė×ćĮæBa(OH)2ČÜŅŗ£ŗH£«£«SO42-£«Ba2£«£«OH£===BaSO4”ż£«H2O |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®ĻņŃĪĖįÖŠµĪ¼Ó°±Ė®£ŗH++OH£=H2O |
| B£®Fe(OH)3ČÜÓŚĒāµāĖį£ŗFe(OH)3+3H+=Fe3++3H2O |
| C£®Ģ¼ĖįĒāÄĘČÜŅŗÖŠĶØČėÉŁĮæSO2£ŗ2HCO3£+SO2£½SO32£+2CO2”ü+H2O |
| D£®Na2S2O3ČÜŅŗÖŠĶØČė×ćĮæĀČĘų£ŗS2O32££«2Cl2£«3H2O£½2SO32££«4Cl££«6H£« |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®ŹÆ»ŅŹÆÓėĮņĖį·“Ó¦ÖĘCO2£ŗCaCO3 + 2H+=Ca2+ + CO2”ü + H2O |
| B£®Na2O2ÓėH2O·“Ó¦ÖʱøO2£ŗNa2O2 + H2O£½ 2Na+ + 2OH£ + O2”ü |
| C£®½«ĀČĘųČÜÓŚĖ®Öʱø“ĪĀČĖį£ŗCl2 + H2O£½ 2H+ + Cl£ + ClO£ |
| D£®ÓĆĮņĖįĖį»ÆµÄKMnO4ČÜŅŗÓėH2O2·“Ó¦£¬Ö¤Ć÷H2O2¾ßÓŠ»¹ŌŠŌ£ŗ |
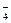 + 6H+ + 5H2O2£½ 2Mn2+ + 5O2”ü + 8H2O
+ 6H+ + 5H2O2£½ 2Mn2+ + 5O2”ü + 8H2O²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com