
| A. | 除去N2中的O2:通过灼热的CuO粉末,收集气体 | |
| B. | 某吸热反应能自发进行,则该反应一定是熵增的反应 | |
| C. |  如图是从化学试剂商店买回的硫酸试剂标签,配制80mL2.3mol•L-1的稀硫酸需量取该硫酸12.5 mL | |
| D. | 下列各种物质在一定条件下反应,所得产物与反应物的用量或与反应条件无关①Na2SiO3+CO2+H2O ②Fe+Cl2 ③Ca(HCO3)2+Ca(OH)2 |
分析 A.二者均不与CuO反应;
B.△H-T△S<0的反应可自发进行;
D.配制80mL2.3mol•L-1的稀硫酸需量取该硫酸12.5 mL,结合稀释前后溶质的物质的量不变计算;
D.①中二氧化硫少量生成碳酸钠,二氧化碳过量生成碳酸氢钠;②中与量、反用条件无关;③中均生成碳酸钙和水.
解答 解:A.二者均不与CuO反应,不能除杂,应选灼热的铜网,故A错误;
B.△H-T△S<0的反应可自发进行,则某吸热反应能自发进行,则该反应可能是熵增的反应,故B错误;
D.配制80mL2.3mol•L-1的稀硫酸,由稀释前后溶质的物质的量不变可知,需量取该硫酸为$\frac{0.1L×2.3mol/L}{\frac{1000×1.84×98%}{98}}$=12.5 mL,故C正确;
D.①中二氧化硫少量生成碳酸钠,二氧化碳过量生成碳酸氢钠;②中与量、反用条件无关;③中均生成碳酸钙和水,则所得产物与反应物的用量或与反应条件无关的只有②③,故D错误;
故选C.
点评 本题考查较综合,涉及混合物分离提纯、反应进行方向、物质的量浓度计算、物质的性质与反应等,注重基础知识的考查,把握物质的性质、反应原理为解答的关键,侧重分析与应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
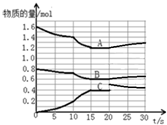 在2L恒容密闭容器中发生反应aA(g)+bB(g)?cC(g)△H>0,容器中A、B、C物质的量随反应时间的变化如图所示,下列有关说法不正确的是( )
在2L恒容密闭容器中发生反应aA(g)+bB(g)?cC(g)△H>0,容器中A、B、C物质的量随反应时间的变化如图所示,下列有关说法不正确的是( )| A. | 反应在前10s 内v(B)=0.005mol/(L.s) | |
| B. | 方程式计量数a:b:c为2:1:2 | |
| C. | 10 s时改变条件可能是升高温度,20s时平衡逆向进行 | |
| D. | 15~20s间,反应的平衡常数是2.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
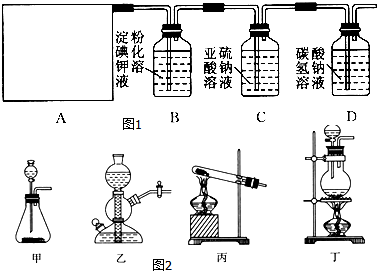
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
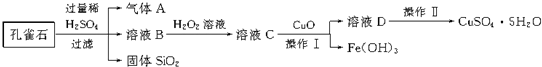
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
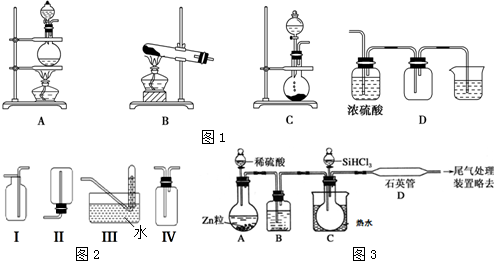
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室用液溴和苯在催化剂作用下制溴苯: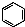 +Br2$\stackrel{FeBr_{3}}{→}$ +Br2$\stackrel{FeBr_{3}}{→}$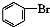 +HBr +HBr | |
| B. | 蛋壳溶于食醋:CaCO3+CH3COOH=CH3COOCa+H2O+CO2↑ | |
| C. | 向CH2BrCOOH中加入足量的氢氧化钠溶液并加热:CH2BrCOOH+OH-$\stackrel{△}{→}$CH2BrCOO-+H2O | |
| D. | 向氯乙烷水溶液中加入氢氧化钠溶液共热:CH3CH2Cl+NaOH$\stackrel{△}{→}$CH2=CH2+NaCl+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
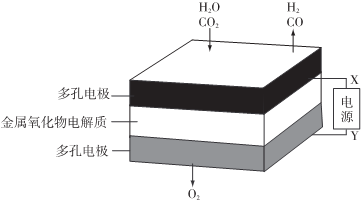
| A. | X是电源的负极 | |
| B. | 阴极的反应式是:H2O+2eˉ═H2+O2- | |
| C. | 总反应可表示为:H2O+CO2═H2+CO+O2 | |
| D. | 阴、阳两极生成的气体的物质的量之比是1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | I-是该反应的催化剂 | |
| B. | H2O2分解的速率取决于第二步反应的快慢 | |
| C. | 反应物的总能量比生成物总能量低98kJ | |
| D. | 第一步H2O2被还原,第二步H2O2既被氧化又被还原 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com