

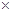 10-2mol·L-1,II中反应所得NaClO2溶液(含少量NaOH)的pH=13,则溶液中
10-2mol·L-1,II中反应所得NaClO2溶液(含少量NaOH)的pH=13,则溶液中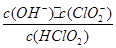 = 。
= 。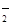 +O2↑+2H2O (3分)
+O2↑+2H2O (3分)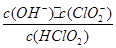 =
=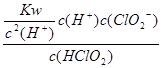 =1.07×1010mol·L-1 。
=1.07×1010mol·L-1 。 2H2SO4+2Cu+O2↑,生成铜3.2 g,则反应了CuSO4的物质的量为0.05mol,生成H2SO4的物质的量为0.05mol,则所得溶液含0.05mol的CuSO4和0.05mol的H2SO4,Cu2+水解生成H+,所以离子浓度由大到小的顺序为:c(H+)>c(SO42-)>c(Cu2+)>c(OH-)。
2H2SO4+2Cu+O2↑,生成铜3.2 g,则反应了CuSO4的物质的量为0.05mol,生成H2SO4的物质的量为0.05mol,则所得溶液含0.05mol的CuSO4和0.05mol的H2SO4,Cu2+水解生成H+,所以离子浓度由大到小的顺序为:c(H+)>c(SO42-)>c(Cu2+)>c(OH-)。

科目:高中化学 来源:不详 题型:问答题
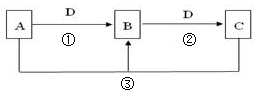
查看答案和解析>>
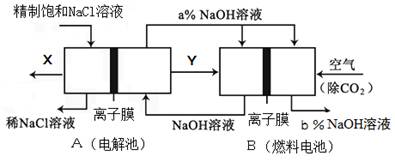
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
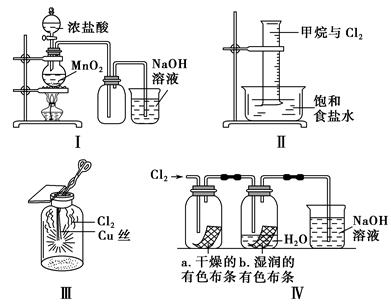
| A.Ⅰ图中:如果MnO2过量,浓盐酸就可被全部消耗 |
| B.Ⅱ图中:量筒中发生了加成反应 |
| C.Ⅲ图中:生成蓝色的烟 |
| D.Ⅳ图中:湿润的有色布条能退色,将硫酸溶液滴入烧杯中,至溶液显酸性,结果有Cl2生成 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.CO2气体通入Na2SiO3溶液中 |
| B.SO2气体通入BaCl2溶液中 |
| C.CO2气体通入饱和Na2CO3溶液中 |
| D.SO2气体通入Ba(OH)2溶液中 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
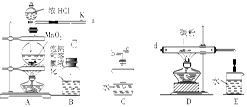
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.CuCl2 | B.FeCl3 | C.AlCl3 | D.FeCl2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
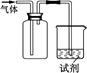
| 选项 | 气体 | 试剂 | 现象 | 结论 |
| A | NO | 紫色石蕊试液 | 溶液变红 | NO与水反应生成硝酸 |
| B | Cl2 | KI淀粉溶液 | 溶液变蓝 | Cl2有氧化性 |
| C | SO2 | 酸性KMnO4溶液 | 溶液褪色 | SO2有漂白性 |
| D | NH3 | 酚酞试剂 | 溶液变红 | NH3有碱性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com