


分析 氧化锌矿(主要成分为ZnO,另含ZnSiO3、FeCO3、CuO等)加稀硫酸溶解,过滤,滤液中含有硫酸锌、硫酸铜、硫酸亚铁,再加高锰酸钾溶液与亚铁离子反应生成MnO(OH)2和氢氧化铁沉淀,过滤,滤液中含有硫酸铜和硫酸锌,加锌粉置换铜离子,过滤,滤渣为Cu可能含有Zn,滤液为硫酸锌,蒸发浓缩、冷却结晶、过滤得到ZnSO4•7H2O晶体;
(1)①根据温度对反应速率的影响分析;
②用氢氧化钠溶液清洗过滤装置,目的是使反应生成的H2SiO3滤渣反应生成Na2SiO3溶解除去;
(2)高锰酸钾与Fe2+反应生成Fe(OH)3和MnO(OH)2;
(3)步骤Ⅲ:向滤液中加入锌粉,置换出铜;
(4)①由于ZnSO4•7H2O易分解,烘干时要适当降低温度;
②28.70 g ZnSO4•7H2O的物质的量为0.1mol,由Zn元素守恒可知,生成ZnSO4•H2O或ZnSO4或ZnO或Zn3O(SO4)2时,物质的量均为0.1mol,根据它们的质量通过排除法确定.
解答 解:氧化锌矿(主要成分为ZnO,另含ZnSiO3、FeCO3、CuO等)加稀硫酸溶解,过滤,滤液中含有硫酸锌、硫酸铜、硫酸亚铁,再加高锰酸钾溶液与亚铁离子反应生成MnO(OH)2和氢氧化铁沉淀,过滤,滤液中含有硫酸铜和硫酸锌,加锌粉置换铜离子,过滤,滤渣为Cu可能含有Zn,滤液为硫酸锌,蒸发浓缩、冷却结晶、过滤得到ZnSO4•7H2O晶体;
(1)①酸浸时,不断通入高温水蒸气可使反应液的温度升高,使反应物充分混合,以加快反应速率,
故答案为:升高温度,使反应物充分混合,以加快反应速率;
②滤渣A为硅酸沉淀,用氢氧化钠溶液清洗过滤装置,目的是使反应生成的H2SiO3滤渣与氢氧化钠反应生成Na2SiO3溶解除去,其发生的反应为:H2SiO3+2NaOH=Na2SiO3+2H2O,
故答案为:H2SiO3+2NaOH=Na2SiO3+2H2O;
(2)在pH约为5.1的滤液中加入高锰酸钾,高锰酸钾与Fe2+发生氧化还原反应,生成Fe(OH)3和MnO(OH)2两种沉淀,则反应的离子方程式为:3Fe2++MnO4-+8H2O=3Fe(OH)3↓+MnO(OH)2↓+5H+,
故答案为:3Fe2++MnO4-+8H2O=3Fe(OH)3↓+MnO(OH)2↓+5H+;
(3)步骤Ⅲ:向含有Cu2+、Zn2+、SO42-的滤液中加入锌粉,置换出铜,可能含有过量的锌粉,
故答案为:Cu(Zn);
(4)①由于ZnSO4•7H2O易分解,烘干时要适当降低温度,防止ZnSO4•7H2O分解,
故答案为:降低烘干的温度,防止ZnSO4•7H2O分解;
②28.70 g ZnSO4•7H2O的物质的量为0.1mol,由Zn元素守恒可知,生成ZnSO4•H2O或ZnSO4或ZnO或Zn3O(SO4)2时,物质的量均为0.1mol,
若得ZnSO4•H2O的质量为17.90g(100℃);
若得ZnSO4的质量为16.10g(250℃);
若得ZnO的质量为8.10g(930℃);
据此通过排除法确定680℃时所得固体的化学式为Zn3O(SO4)2;
故答案为:d.
点评 本题以ZnSO4•7H2O的制备为知识背景,考查了基本实验操作、氧化还原反应、化学反应速率的影响因素、化学方程式的书写、计算等知识,题目难度中等,侧重于考查学生的分析能力和实验能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
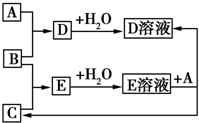 已知A、B、C为中学化学中常见的单质.室温下,A为固体,B和C均为气体.在适宜的条件下,它们可以按如图进行反应.下列说法中不正确的是( )
已知A、B、C为中学化学中常见的单质.室温下,A为固体,B和C均为气体.在适宜的条件下,它们可以按如图进行反应.下列说法中不正确的是( )| A. | A、B、C中三种元素的任意两种元素形成的化合物所属物质类别可能是氧化物 | |
| B. | A、B、C中三种元素形成的化合物所属物质类别一定不是碱 | |
| C. | 如果E溶液是一种强酸,则E溶液为盐酸 | |
| D. | A、B、C中有一种金属且为A |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液中含有1mol Na2SO4 | |
| B. | 将1mol Na2SO4溶于1L中可得到该溶液 | |
| C. | 溶液中Na+的物质的量浓度为2mol•L-1 | |
| D. | 1L该溶液中含有2mol Na+和2mol SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀硫酸滴加在铜片上:Cu+2H+═Cu2++H2↑ | |
| B. | 氢氧化镁溶解于盐酸:OH?+H+═H2O | |
| C. | 金属铁跟稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| D. | 铜和硝酸银溶液反应:Cu+2Ag+═2Ag+Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溴苯(液溴):加NaOH溶液,充分振荡,分液,留下层液体 | |
| B. | 乙醇(乙醛):加新制Cu(OH)2溶液,加热至沸腾,过滤取溶液即可 | |
| C. | 乙烷(乙烯):通过盛有足量溴水溶液的洗气瓶洗气 | |
| D. | 乙酸乙酯(乙酸):加饱和碳酸钠溶液,充分振荡,分液,留上层液体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com