
【题目】有一瓶澄清的溶液,其中可能含有H+、NH4+、K+、Ba2+、Al3+、Fe3+、I-、NO3-、CO32-、SO42-、AlO2-。取该溶液进行以下实验:
①用pH试纸检验,溶液呈强酸性;
②取溶液适量,加入少量CCl4和数滴新制氯水,振荡,CCl4层呈紫红色;
③另取溶液适量,逐滴加入NaOH溶液:
A.溶液从酸性变为中性,中性变为碱性;
B.溶液逐渐产生沉淀;
C.沉淀完全溶解;
D.最后加热溶液,有气体放出,该气体能使湿润的红色石蕊试纸变蓝;
④取适量③得到的碱性溶液,加入Na2CO3溶液,有白色沉淀生成。
根据上述实验现象,回答下列问题。
(1)由①可以排除__________的存在。
(2)由②可以证明________的存在,同时排除___________的存在;理由是___________________________。
(3)由③可以证明________的存在;写出c、d所涉及的化学方程式,是离子反应的用离子方程式表示:
c._______________;
d._______________。
(4)由④证明__________的存在,同时可以排除________的存在。
【答案】(1)CO32- AlO2-
(2)I- Fe3+、NO3- 碘离子与铁离子、稀硝酸均会发生氧化还原反应
(3)Al3+、NH4+ Al(OH)3+OH-=Al(OH)4- NH3·H2O![]() NH3↑+H2O
NH3↑+H2O
(4)Ba2+ SO42-
【解析】
试题分析:①用pH试纸检验,溶液呈强酸性,溶液中一定含有H+,则一定不含有与H+不共存的CO32-和AlO2-;②取溶液适量,加入少量CCl4和数滴新制氯水,振荡,CCl4层呈紫红色,则溶液中一定含有I-,I-与氯水反应生成I2,使CCl4层呈紫红色;由于I-与Fe3+及酸性条件下的NO3-因发生氧化还原反应而不共存,因此一定无Fe3+和NO3-;实验③,逐滴加入NaOH溶液,先产生沉淀,后沉淀溶解,证明溶液中有Al3+;最后加热溶液,有气体放出,该气体能使湿润的红色石蕊试纸变蓝,该气体为NH3,证明溶液中含有NH4+;④取适量③得到的碱性溶液,加入Na2CO3溶液,有白色沉淀生成,证明溶液中含有Ba2+,则溶液中一定不含有SO42-;由以上实验不能确定是否含有K+。据此进行解答。
(1)由以上分析可知,由①可以排除CO32-和AlO2-;
(2)由②可以证明I-的存在,同时排除Fe3+和NO3-的存在,原因是碘离子与铁离子、稀硝酸均会发生氧化还原反应;
(3)由③可以证明Al3+和NH4+的存在,c、d所涉及的化学方程式为:Al(OH)3+OH-=[Al(OH)4]- NH3·H2O![]() NH3↑+H2O;
NH3↑+H2O;
(4)由④证明Ba2+的存在,同时排除SO42-的存在。


科目:高中化学 来源: 题型:
【题目】下列有关表述正确的是
(1)-OH与![]() 组成元素相同,含有的电子数也相同
组成元素相同,含有的电子数也相同
(2)次氯酸的电子式为:![]()
(3)Mg2+的离子结构示意图: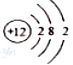
(4)CO2的球棍模型示意图:![]()
(5)熔化时NaHSO4的电离方程式为NaHSO4=Na+ + HSO4-
A.(1)(2) B.(3)(5)
C.(4)(5) D.(1)(5)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】热激活电池可用作火箭、导弹的工作电源。一种热激活电池的基本结构如图所示,作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为:PbSO4+2LiCl+Ca = CaCl2+Li2SO4+Pb。下列有关说法正确的是

A.正极反应式:Ca + 2Cl--2e- = CaCl2
B.放电过程中,Li+向负极移动
C.常温时,在正负极间接上电流表或检流计,指针发生偏转
D.每转移0.1mol电子,理论上生成10.35 g Pb
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A.甲烷的燃烧热H=-890.3KJ
B.炭生成一氧化碳的燃烧热是111KJ/mol
C.中和热H=-57.3KJ/mol
D.醋酸与NaOH反应的中和热小于-57.3KJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向IL0.1mol/LNH4Cl溶液中,不断加入固体NaOH后,NH4+与NH3·H2O的变化趋势如右图所示(不考虑体积变化和氨的挥发),下列说法不正确的是

A.M点溶液中水的电离程度比原溶液小
B.在M点时,n(OH-)-n(H+)=(a-0.05)mol
C.随者NaOH的加入,c(H+)/c(NH4+)不断增大
D.当n(NaOH)=0.1mol时,c(OH-)>c(Cl-)-c(NH3·H20)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】.下列说法错误的是 ( )
A. 2H2S+SO2=3S+2H2O中,氧化产物和还原产物物质的量之比为2:1
B. 4Zn+10HNO3=4Zn(NO3)2+NH4NO3+3H2O中,氧化剂和还原剂物质的量之比为5:2
C. 3I2+6KOH![]() 5KI+KIO3+3H2O中,被氧化和被还原的碘元素物质的量之比为1:5
5KI+KIO3+3H2O中,被氧化和被还原的碘元素物质的量之比为1:5
D. 2FeS+6H2SO4(浓)![]() Fe2(SO4)3+3SO2+2S↓+6H2O中,反应中发生氧化反应和发生还原反应的硫元素物质的量之比为2:3
Fe2(SO4)3+3SO2+2S↓+6H2O中,反应中发生氧化反应和发生还原反应的硫元素物质的量之比为2:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,属于氧化还原反应的是 ( )
A. 2H2O2![]() 2H2O+O2↑
2H2O+O2↑
B. 2Al(OH)3![]() Al2O3+3H2O
Al2O3+3H2O
C. FeO+2HCl=FeCl2+H2O
D. CuCl2+2NaOH=Cu(OH)2↓+2NaCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2CO(g)+O2(g)=2CO2(g)ΔH=-566kJ/mol
Na2O2(s)+CO2(g)=Na2CO3(s)+![]() O2(g)ΔH=-226kJ/mol
O2(g)ΔH=-226kJ/mol
根据以上热化学方程式判断,下列说法正确的是
A. CO的燃烧热为283 kJ
B. 如图可表示由CO生成CO2的反应过程和能量关系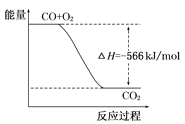
C. 2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g) ΔH>-452 kJ/mol
D. CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com