
【题目】[化学—选修3:物质结构与性质]四川含有丰富的矿产资源,钒矿、钛矿、黄铁矿等七种矿产储量位居全国第1位。回答下列问题:
(1)V2O5常用作SO2 转化为SO3的催化剂。SO2 分子中键角 120°(填“>”、“<”或“=”);SO3分子中S原子的杂化轨道类型为 ;V2O5 溶解在NaOH溶液中,可得到钒酸钠(Na3VO4),该盐阴离子的立体构型为 。
(2)VO2+在酸性条件下可被草酸(H2C2O4)还原为VO2+,草酸被氧化为CO2,该反应用于钒含量的测定。写出反应的离子方程式 。
(3)钛在元素周期表中的位置为 ,其电子排布式为 。用乙醚从TiCl3的饱和溶液中萃取可得TiCl3·6H2O绿色晶体,其配位数为6,将1mol该晶体加入到足量硝酸银溶液中可得2mol白色沉淀,则该配合物的化学式是 。
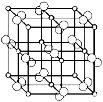
(4)科学家通过X射线探明,黄铁矿(FeS2)的晶体结构与NaCl的晶体结构相似,若在FeS2晶体中阴阳离子间最近距离为a cm,阿伏伽德罗常数为NA。则晶体密度表达式为 g/cm3。
【答案】(13分)除标注外,每空1分 (1) <;sp2(杂化);正四面体
(2) 2VO2++H2C2O4+2H+=2VO2++2CO2![]() +2H2O(3分)
+2H2O(3分)
(3) 第四周期IVB族;[Ar]3d24s2;[Ti(H2O)5Cl]Cl2·H2O(2分) (4) (3分)
【解析】
试题分析:(1)SO2分子中S原子形成2个δ键,孤电子对数为![]() =1,则SO2分子空间构型为V形,孤对电子的排斥作用力强,键角应小于120°;SO3的三聚体中S原子形成4个δ键,为sp3杂化;VO43-中,V形成4个δ键,孤电子对数为
=1,则SO2分子空间构型为V形,孤对电子的排斥作用力强,键角应小于120°;SO3的三聚体中S原子形成4个δ键,为sp3杂化;VO43-中,V形成4个δ键,孤电子对数为![]() =0,为正四面体结构;
=0,为正四面体结构;
(2)VO2+在酸性条件下可被草酸(H2C2O4)还原为VO2+,草酸被氧化为CO2,发生反应的离子方程式为2VO2++H2C2O4+2H+=2VO2++2CO2![]() +2H2O;
+2H2O;
(3)钛的核电荷数为22,价电子排布式为3d24s2,则在元素周期表中的位置为第四周期IVB族,其电子排布式为[Ar]3d24s2;用乙醚从TiCl3的饱和溶液中萃取可得,将1mol晶体TiCl3·6H2O加入到足量硝酸银溶液中可得2mol白色沉淀,可知能电离出2molCl-,绿色晶体TiCl3·6H2O配位数为6,则该配合物的化学式为[Ti(H2O)5Cl]Cl2·H2O。
(4)FeS2的晶体结构与NaCl的晶体结构相似,则一个晶胞中含有4个“FeS2”,NA个“FeS2”的质量为120g,由图可知,FeO晶体中阴阳离子间最近距离为acm,则体积为(2acm)3,质量为(2acm)3×ρg/cm3,所以(2acm)3ρg/cm3×NA=120g×4,则ρ=g/cm3。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
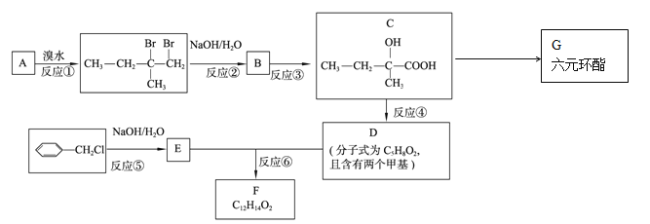
【题目】(有机化学基础)分子式为C12H14O2的有机物F广泛用于制备香精的调香剂。为了合成该有机物,某实验室的科技人员设计了下列合成路线。
 试回答下列问题:
试回答下列问题:
(1)A物质名称为(系统命名) 。
(2)合成路线中反应③所属反应类型为 。
(3)有机物G的结构简式为 。
(4)有机物D中所含官能团的名称为 。
(5)关于有机物C,下列说法正确的是( )
A.等物质的量的C分别与足量的金属钠和NaHCO3反应,后者产生气体多
B.一定条件下,有机物C能通过缩聚反应形成高分子化合物
C.1molC完全燃烧生成CO2和H2O,消耗的氧气的物质的量为6mol
D.有机物C中的所有碳原子可能在同一平面上
(6)反应⑥的化学反应方程式为 。
(7)F有多种同分异构体,请写出符合下列条件的所有同分异构体的结构简式:①属于芳香族化合物,且含有与F相同的官能团;②苯环上有两个取代基,且苯环上的一氯代物只有两种;③其中一个取代基为-CH2COOCH3; 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学—选修5:有机化学基础】
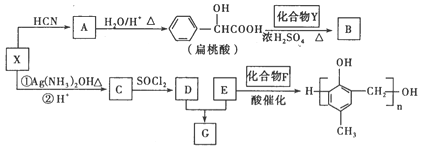
有机化合物X、Y、A、B、C、D、E、F、G之间的转化关系如下图。
已知以下信息:
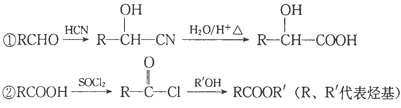
③X在催化剂作用下可与H2反应生成化合物Y。
④化合物F的核磁共振氢谱图中只有一个吸收峰。
回答下列问题:
(1)X的含氧官能团的名称是________,X与HCN反应生成A的反应类型是_________。
(2)酯类化合物B的分子式是C15H14O3,其结构简式是_____________。
(3)X发生银镜反应的化学方程式是______________________。
(4)G在NaOH溶液中发生水解反应的化学方程式是__________________。
(5)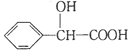 的同分异构体中:①能发生水解反应;②能发生银镜反应;
的同分异构体中:①能发生水解反应;②能发生银镜反应;
③能与氯化铁溶液发生显色反应;④含氧官能团处在对位。满足上述条件的同分异构体共有________种(不考虑立体异构),写出核磁共振氢谱图中有五个吸收峰的同分异构体的结构简式__________________。
(6)写出以C2H5OH为原料合成乳酸(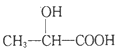 )的路线(其它试剂任选)。(合成路线常用的表示方式为:A
)的路线(其它试剂任选)。(合成路线常用的表示方式为:A![]() B……
B……![]() 目标产物)
目标产物)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于化学反应中的能量变化,表述正确的是( )
A. 需要加热的化学反应都是吸热反应 B. 中和反应都是放热反应
C. 原电池是将电能转化为化学能的一种装置 D. 水力发电是将化学能转化为电能的过程
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、通常情况下,微粒A和B为分子,C和E为阳离子,D为阴离子,它们都含有10个电子;B溶于A后所得的物质可电离出C和D;A、B、E三种微粒反应后可得C和一种白色沉淀。请回答。
(1)用化学符号表示下列微粒:C:________,D:_________。
(2)写出A、B、E三种微粒反应的离子方程式:______________________。
II、A、B、C、D、E是原子序数依次增大的五种短周期元素,A原子的电子层数与它的核外电子总数相同,A与C、B与D分别为同主族,B和C的最外层电子数之和与E的最外层电子数相同。A与E形成的化合物的化学式为AE,其分子中含18个电子。请回答下列问题:
(1)D元素的原子结构示意图为___________________。
(2)由A、B、C三种元素形成的化合物的电子式为_________________,这种化合物中所含的化学键类型有___________________。
(3)A2B的沸点高于A2D,其原因是______________________。
(4)B、C、E三种元素形成一种盐,此盐中三种原子个数比为1:1:1,在25℃时,将该盐溶于水,测得溶液pH>7,理由是_________________(用离子方程式表示);将该盐溶液在空气中露置一段时间后(充分光照,不考虑水分的挥发),溶液的pH近似为7,则该过程的总化学反应方程式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氯化二硫(S2C12)是广泛用于橡胶工业的硫化剂,其分子结构如右图所示。常温下,S2C12是一种橙黄色液体,遇水易水解,并产生能使品红褪色的气体,化学方程式为:2S2C12+2H2O=SO2↑+3S↓+4HCl。下列说法中错误的是
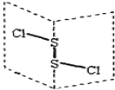
A.S2C12的结构式为Cl—S—S—Cl
B.反应中SO2是还原产物,S是氧化产物
C.S2C12为含有极性键和非极性键的分子
D.反应中,生成1molSO2,转移电子为3mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com