
| A. | 苯甲醇 | B. | 环己醇 | C. | 1-己醇 | D. | 间甲基苯甲醇 |
分析 有机物无论它们以何种物质的量的比例混和,只要总物质的量一定,则在完全燃烧时,消耗氧气的量为一定值,设有机物通式为CxHyOz,则(x+$\frac{y}{4}$-$\frac{z}{2}$)值相等,据此计算解答.
解答 解:环己烷(C6H12)消耗的氧气为(x+$\frac{y}{4}$-$\frac{z}{2}$)=6+$\frac{12}{4}$=9.
A.苯甲醇(C6H5CH2OH)(x+$\frac{y}{4}$-$\frac{z}{2}$)=7+$\frac{8}{4}$-$\frac{1}{2}$=8.5,故A错误;
B.环己醇(C6H11OH)(x+$\frac{y}{4}$-$\frac{z}{2}$)=6+$\frac{12}{4}$-$\frac{1}{2}$=8.5,故B错误;
C.1-己醇(C6H13OH)(x+$\frac{y}{4}$-$\frac{z}{2}$)=6+$\frac{14}{4}$-$\frac{1}{2}$=9,故C正确;
D.间甲基苯甲醇(CH3C6H4CH2OH)(x+$\frac{y}{4}$-$\frac{z}{2}$)=8+$\frac{10}{4}$-$\frac{1}{2}$=10,故D错误;
故选C.
点评 本题考查有机物耗氧量的计算,题目难度不大,根据烃及烃的含氧衍生物的燃烧通式,确定(x+$\frac{y}{4}$-$\frac{z}{2}$)值相等是关键.


科目:高中化学 来源: 题型:实验题

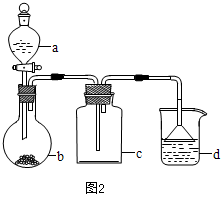
| 选项 | a物质 | b物质 | c收集的气体 | d中的物质 |
| A | 浓氨水 | NaOH | NH3 | H2O |
| B | 浓硫酸 | Na2SO3 | SO2 | 澄清石灰水 |
| C | 稀硝酸 | Cu | NO2 | H2O |
| D | 浓盐酸 | KMnO4 | Cl2 | NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 先生成沉淀,后沉淀全部溶解 | |
| B. | 当溶液中Ba2+全部沉淀出来时,沉淀的总物质的量最大 | |
| C. | 最后得到的沉淀是BaSO4 | |
| D. | 最后的沉淀为2 mol BaSO4、1 mol Al(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 “封管实验”具有简易、方便、节约、绿色等优点,下列关于三个“封管实验”(夹持装置未画出)的说法正确的是( )
“封管实验”具有简易、方便、节约、绿色等优点,下列关于三个“封管实验”(夹持装置未画出)的说法正确的是( )| A. | 加热时,①中上部汇集了NH4Cl固体 | |
| B. | 加热时,②中溶液变红,冷却后又都变为无色 | |
| C. | 加热时,③中溶液变红,冷却后红色褪去,体现SO2的漂白性 | |
| D. | 三个“封管实验”中所发生的化学反应都是可逆反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 根据同周期元素的第一电离能变化趋势,推出Al的第一电离能比Mg大 | |
| B. | 根据主族元素最高正化合价与族序数的关系,推出卤族元素最高正价都是+7 | |
| C. | 根据结构相似的分子的熔点与相对分子质量的关系,推出PH3比NH3熔点高 | |
| D. | 根据较强酸可以制取较弱酸的规律,推出CO2通入NaClO溶液中能生成HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 序号 | 现象 | 结论 |
| I | B装置中黑色氧化铜变为红色 | 反应生成了Cu或Cu2O |
| II | C装置中无水CuSO4变蓝 | 反应生成了H2O |
| III | E装置中收集到无色无味气体 | 反应生成了N2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 《本草纲目》记载“烧酒非古法也,自元时创始,其法用浓酒精和糟入瓯(指蒸锅),蒸令气上,用器承滴露.” | |
| B. | 《肘后备急方》记载“青蒿一握,以水二升渍,绞取汁.” | |
| C. | 《泉州府志》物产条载“初,人不知盖泥法,元时南有黄安长者为宅煮糖,宅坦忽坏,去土而糖白,后人遂效之.” | |
| D. | 《梦溪笔谈》记载“信州铅山县有苦泉,…挹其水熬之,则成胆矾,熬胆矾铁釜,久之亦化为铜.” |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 80% | B. | 40% | C. | 60% | D. | 20% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com