
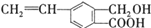
 ,关于有机物M的说法正确的是( )
,关于有机物M的说法正确的是( )| A、有机物M的分子式为C10H12O3 |
| B、1mol Na2CO3最多能消耗1mol有机物M |
| C、1mol M和足量金属钠反应生成22.4L气体 |
| D、有机物M能发生取代、氧化和加成反应 |


 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案科目:高中化学 来源: 题型:
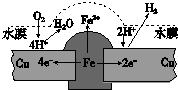 铜板上铁铆钉长期暴露在潮湿的空气中,形成一层酸性水膜后铁铆钉会被腐蚀,示意图如图.下列说法不正确的是( )
铜板上铁铆钉长期暴露在潮湿的空气中,形成一层酸性水膜后铁铆钉会被腐蚀,示意图如图.下列说法不正确的是( )| A、因铁的金属性比铜强,所以铁铆钉被氧化而腐蚀 |
| B、若水膜中溶解了SO2,则铁铆钉腐蚀的速率变小 |
| C、铜极上的反应是2H++2e-═H2↑,O2+4e-+4H+═2H2O |
| D、在金属表面涂一层油脂,能防止铁铆钉被腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、利用植物油的加成反应可以制得人造黄油 |
| B、75%的酒精可使蛋白质变性从而起到消毒作用 |
| C、纤维素在人体内可水解成葡萄糖,供人体组织的营养需要 |
D、可用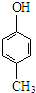 和HCHO为原料合成 和HCHO为原料合成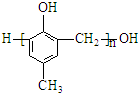 |
查看答案和解析>>
科目:高中化学 来源: 题型:
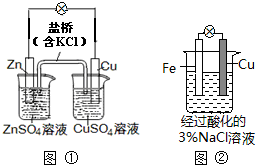
| A、图①中正极附近溶液pH降低 |
| B、图①中电子由Zn流向Cu,盐桥中的Cl-移向CuSO4溶液 |
| C、图②正极反应是O2+2H2O+4e-═4OH- |
| D、图②中加入少量K3[Fe(CN)6]溶液,有蓝色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子半径的大小顺序:W>Z>Y>X |
| B、化合物Z2Y2与X2Y反应时,Z2Y2既是氧化剂又是还原剂 |
| C、元素Y的简单气态氢化物的热稳定性比W的弱 |
| D、由X、Y、Z、W四种元素组成的化合物对水的电离平衡一定是促进的 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、蚕丝、过氧化氢酶、核酸充分水解后均可得到α-氨基酸 |
| B、某些铝硅酸盐形成的分子筛中有许多笼状空穴和通道,可作干燥剂、离子交换剂、催化剂及催化剂载体等 |
| C、酸碱质子理论进一步扩大了人们对酸碱的认识,可以解释一些非水溶液中进行的酸碱反应等问题 |
| D、借助扫描隧道显微镜,应用STM技术可实现对原子或分子的操纵 |
查看答案和解析>>
科目:高中化学 来源: 题型:

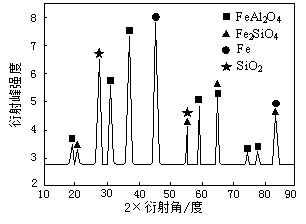
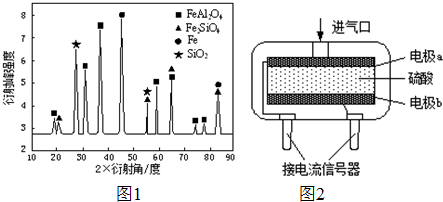
查看答案和解析>>
科目:高中化学 来源: 题型:
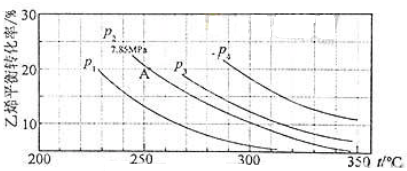
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com