
【题目】为探究X(仅含三种元素)的组成和热稳定性,设计并完成如下实验:
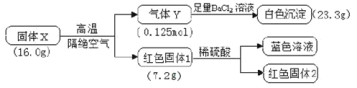
气体Y不能使品红溶液褪色,红色固体1是一种纯净物,请回答:
(1)X除了含有Cu元素之外,还有___元素(填元素符号)。
(2)该流程中X高温分解的化学方程式为____。
(3)写出气体Y通入BaCl2溶液发生反应的离子方程式___。
【答案】S、O 4CuSO4![]() 2Cu2O+4SO3↑+O2↑ SO3+H2O+Ba2+=2H++BaSO4↓或SO3+H2O=2H++SO42-、SO42-+Ba2+=BaSO4↓
2Cu2O+4SO3↑+O2↑ SO3+H2O+Ba2+=2H++BaSO4↓或SO3+H2O=2H++SO42-、SO42-+Ba2+=BaSO4↓
【解析】
16.0g固体X高温隔绝空气分解生成0.125mol气体Y和7.2g红色固体1,由质量守恒定律可知,气体Y的质量为8.8g,气体Y与足量BaCl2溶液作用生成的白色沉淀为BaSO4,质量为23.3g,其物质的量为![]() =0.1mol,则混合气体中含有0.1molSO3,另一种气体的物质的量为0.025mol,质量为8.8g-0.1mol×80g/mol=0.8g,则该气体的摩尔质量为
=0.1mol,则混合气体中含有0.1molSO3,另一种气体的物质的量为0.025mol,质量为8.8g-0.1mol×80g/mol=0.8g,则该气体的摩尔质量为![]() =32g/mol,此气体为O2,即气体Y为SO3和O2的混合气体,且物质的量之比为0.1mol:0.025mol=4:1;纯净的红色固体1溶于稀硫酸得到蓝色溶液和红色固体2,可知溶液中含有Cu2+,红色固体2为Cu,则红色固体1为Cu2O,其物质的量为
=32g/mol,此气体为O2,即气体Y为SO3和O2的混合气体,且物质的量之比为0.1mol:0.025mol=4:1;纯净的红色固体1溶于稀硫酸得到蓝色溶液和红色固体2,可知溶液中含有Cu2+,红色固体2为Cu,则红色固体1为Cu2O,其物质的量为![]() =0.05mol,由此可知X有Cu、S、O三种元素组成,三者的物质的量比为(0.05mol×2):0.1mol:(0.05mol+0.1mol×3+0.025mol×2)=1:1:4,则固体X为CuSO4,据此分析解题。
=0.05mol,由此可知X有Cu、S、O三种元素组成,三者的物质的量比为(0.05mol×2):0.1mol:(0.05mol+0.1mol×3+0.025mol×2)=1:1:4,则固体X为CuSO4,据此分析解题。
16.0g固体X高温隔绝空气分解生成0.125mol气体Y和7.2g红色固体1,由质量守恒定律可知,气体Y的质量为8.8g,气体Y与足量BaCl2溶液作用生成的白色沉淀为BaSO4,质量为23.3g,其物质的量为![]() =0.1mol,则混合气体中含有0.1molSO3,另一种气体的物质的量为0.025mol,质量为8.8g-0.1mol×80g/mol=0.8g,则该气体的摩尔质量为
=0.1mol,则混合气体中含有0.1molSO3,另一种气体的物质的量为0.025mol,质量为8.8g-0.1mol×80g/mol=0.8g,则该气体的摩尔质量为![]() =32g/mol,此气体为O2,即气体Y为SO3和O2的混合气体,且物质的量之比为0.1mol:0.025mol=4:1;纯净的红色固体1溶于稀硫酸得到蓝色溶液和红色固体2,可知溶液中含有Cu2+,红色固体2为Cu,则红色固体1为Cu2O,其物质的量为
=32g/mol,此气体为O2,即气体Y为SO3和O2的混合气体,且物质的量之比为0.1mol:0.025mol=4:1;纯净的红色固体1溶于稀硫酸得到蓝色溶液和红色固体2,可知溶液中含有Cu2+,红色固体2为Cu,则红色固体1为Cu2O,其物质的量为![]() =0.05mol,由此可知X有Cu、S、O三种元素组成,三者的物质的量比为(0.05mol×2):0.1mol:(0.05mol+0.1mol×3+0.025mol×2)=1:1:4,则固体X为CuSO4;
=0.05mol,由此可知X有Cu、S、O三种元素组成,三者的物质的量比为(0.05mol×2):0.1mol:(0.05mol+0.1mol×3+0.025mol×2)=1:1:4,则固体X为CuSO4;
(1)由分析知:X除了含有Cu元素之外,还有S、O元素;
(2)X的分解产物为SO3、O2和Cu2O,三者的物质的量比为0.1mol:0.025mol:0.05mol=4:1:2,则CuSO4高温分解的化学方程式为4CuSO4![]() 2Cu2O+4SO3↑+O2↑;
2Cu2O+4SO3↑+O2↑;
(3)气体Y为SO3和O2的混合气体,通入BaCl2溶液生成BaSO4沉淀,发生反应的离子方程式为SO3+H2O+Ba2+=2H++BaSO4↓或SO3+H2O=2H++SO42-、SO42-+Ba2+=BaSO4↓。


科目:高中化学 来源: 题型:
【题目】根据下图,回答问题。
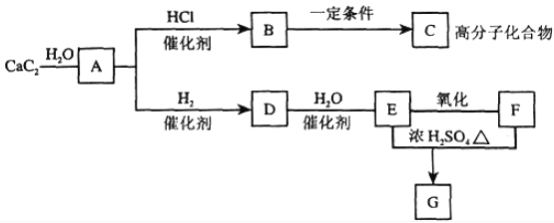
(1)有机物C的结构简式:________。
(2)①反应DE的化学方程式是_____________。
②E和F反应生成G的化学方程式是__________,反应类型为_________。
③实验室制取A的化学方程式__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物苯:常常作为工农业生产中的良好溶剂。
(1)若将苯倒入盛有碘水的试管中,振荡后静置,现象是__________________________,说明苯的密度比水_________,且________________。
(2)若将乒乓球碎片、食盐固体分别加入盛有苯的试管中,振荡后静置,现象是___________________,说明苯是很好的_____________________________。
(3)将盛有苯的两支试管分别插入100℃的沸水和0℃的冰水的现象是________________________,说明苯的沸点_________________,熔点_________。
人们对苯的认识有一个不断深化的过程。
(4)由于苯的含碳量与乙炔相同,人们认为它是一种不饱和烃,写出分子式为C6H6的一种含两个三键且无支链的链烃的结构简式_____________________________________。
(5)已知分子式为C6H6的有机物有多种,其中的两种为:
(I)![]() (II)
(II)![]() 这两种结构的区别表现在以下两方面:
这两种结构的区别表现在以下两方面:
①定性方面(即化学性质方面):(II)能___________(填字母),而(I)不能。
a. 被高锰酸钾酸性溶液氧化 b. 与溴水发生取代反应
c. 与溴发生取代反应 d. 与氢气发生加成反应
②定量方面(即消耗反应物的量的方面):1molC6H6与H2加成时:(I)需要H2______mol,而(II)需要H2_____mol。
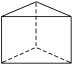
(6)今发现C6H6还可能有另一种如右图所示的立体结构,该结构的一氯代物有_________种;现代化学认为苯分子中碳碳之间的键是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸镍是电镀工业必不可少的化工原料。从不锈钢废渣(主要含Fe42.35%、Cr9.67%、Ni5.1%、C4.7%、Si3.39%等)中制取硫酸镍晶体的工艺流程如图:
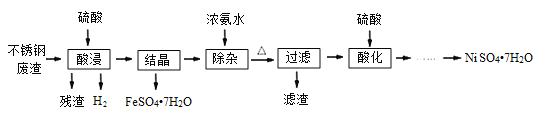 已知:①Cr3+与氨水反应时有少量Cr3+生成[Cr(NH3)6]3+,但加热时该络合物易分解。Ni2+与氨水反应生成[Ni(NH3)6]2+,该络合物加热时稳定,用硫酸酸化时生成相应的硫酸盐。
已知:①Cr3+与氨水反应时有少量Cr3+生成[Cr(NH3)6]3+,但加热时该络合物易分解。Ni2+与氨水反应生成[Ni(NH3)6]2+,该络合物加热时稳定,用硫酸酸化时生成相应的硫酸盐。
②Na2CrO4溶液中加酸调节pH为3.5时,CrO42-转化为Cr2O72-。
③相关物质在不同温度时溶解度如下表:
温度 溶解度/g 物质 | 20℃ | 30℃ | 40℃ | 60℃ | 80℃ | 90℃ |
Na2SO4 | 19.5 | 40.8 | 48.8 | 45.3 | 43.7 | 42.7 |
Na2Cr2O7 | 183 | 198 | 215 | 269 | 376 | 405 |
(1)“酸浸”后得到的溶液中主要含有FeSO4、NiSO4、Cr2(SO4)3,生成NiSO4的化学方程式为___。“酸浸”时需控制温度为90℃左右,可以采用的加热方式是___。
(2)“过滤”前,适当加热的目的是___。
(3)对“过滤”所得的滤渣进行洗涤,检验滤渣已洗涤干净的方法是___。
(4)“过滤”时产生的滤渣可用于制备Na2Cr2O7晶体。
①滤渣经干燥后与Na2CO3混合在空气中煅烧生成Na2CrO4和CO2,此反应的化学方程式为___。
②请补充完整上述煅烧后混合物制备Na2Cr2O7晶体(橙红色)的实验方案:水浸,过滤,___,烘干得Na2Cr2O7晶体(必须使用的试剂有:硫酸,蒸馏水)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(乙酸锰可用于制造钠离子电池的负极材料。可用如下反应制得乙酸锰:4Mn(NO3)26H2O+26(CH3CO)2O=4(CH3COO)3Mn+8HNO2+3O2↑+40CH3COOH
(1)Mn3+基态核外电子排布式为___。
(2)NO3-中氮原子轨道的杂化类型是___。
(3)与HNO2互为等电子体的一种阴离子的化学式为___。
(4)配合物[Mn(CH3OH)6]2+中配位原子是___。
(5)CH3COOH能与H2O任意比混溶的原因,除它们都是极性分子外还有___。
(6)镁铝合金经过高温淬火获得一种储钠材料,其晶胞为立方结构(如图所示),图中原子位于顶点或面心。该晶体中每个铝原子周围距离最近的镁原子数目为___。
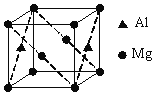
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g),下列叙述中正确的是( )
4NO(g)+6H2O(g),下列叙述中正确的是( )
A.达到化学平衡时4υ正(O2)=5υ逆(NO)
B.若单位时间内生成xmolNO的同时,消耗xmolNH3,则反应达平衡状态
C.达到化学平衡时,若升高温度,则正反应速率减小,逆反应速率增大
D.平衡时混合物中可能各物质的浓度相等,且保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】螺环烃是指分子中两个碳环共用一个碳原子的脂环烃。![]() 是其中一种,下列关于该化合物的说法错误的是( )
是其中一种,下列关于该化合物的说法错误的是( )
A.该化合物的分子式为C9H12
B.一氯代物有四种
C.该化合物可以发生氧化、取代、加成、加聚等反应
D.与Br2以物质的量之比l:1加成生成2种产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知原子序数,可能推断原子的
①质子数 ②中子数 ③质量数 ④核电荷数 ⑤核外电子数
⑥原子结构示意图 ⑦元素在周期表中的位置
A. ①②③④⑥ B. ①④⑤⑥⑦
C. ②③④⑤⑦ D. ③④⑤⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】早期发现的一种天然二十面体准晶颗粒由Al、Cu、Fe 三种金属元素组成,回答下列问题:
(1)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过_______方法区分晶体、准晶体和非晶体。
(2)基态 Fe原子有_______个未成对电子,Fe3+的电子排布式为 _____,可用硫氰化钾检验Fe3+,形成的配合物的颜色为________ 。
(3)新制备的Cu(OH)2可将乙醛〔CH3CHO)氧化成乙酸,而自身还原成Cu2O。乙醛中碳原子的杂化轨道类型为____________,乙酸的沸点明显高于乙醛,其主要原因是________。Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有_______个铜原子。
(4)Al单质为面心立方晶体,其晶胞参数a=0.405nm,晶胞中铝原子的配位数为_____ 。列式表示Al单质的密度___________g·cm-3(不必计算出结果)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com