

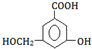
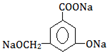
 .
.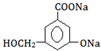 .
.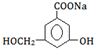 .
. 分析 (1)B装置进行酯化反应效果比A要好,B中冷凝管的冷凝效果比长导管的冷凝效果好;C装置进行酯化反应效果更好,因C中分水器可分离出水,冷凝管可冷凝回流反应物;
(2)① →
→ ,酚-OH、-COOH、-OH均反应;
,酚-OH、-COOH、-OH均反应;
② →
→ ,只有酚-OH、-COOH反应;
,只有酚-OH、-COOH反应;
③ →
→ 中,只有-COOH反应.
中,只有-COOH反应.
解答 解:(1)B装置进行酯化反应效果比A要好,理由是便于冷凝回流,减少反应物损失;C装置进行酯化反应效果更好,理由是既能冷凝回流又能及时分离出反应生成的水,有利于酯的生成,
故答案为:便于冷凝回流,减少反应物损失;既能冷凝回流又能及时分离出反应生成的水,有利于酯的生成;
(2)① →
→ ,酚-OH、-COOH、-OH均反应,则应与Na反应,故答案为:Na;
,酚-OH、-COOH、-OH均反应,则应与Na反应,故答案为:Na;
② →
→ ,只有酚-OH、-COOH反应,则与NaOH溶液或Na2CO3溶液反应,故答案为:NaOH溶液或Na2CO3溶液;
,只有酚-OH、-COOH反应,则与NaOH溶液或Na2CO3溶液反应,故答案为:NaOH溶液或Na2CO3溶液;
③ →
→ 中,只有-COOH反应,则与NaHCO3溶液反应,故答案为:NaHCO3溶液.
中,只有-COOH反应,则与NaHCO3溶液反应,故答案为:NaHCO3溶液.
点评 本题考查有机物的制备实验及有机物的结构与性质,为高频考点,把握实验装置的作用、实验技能、有机物的结构与性质为解答的关键,侧重分析与应用能力的考查,注意平衡移动原理及官能团与性质的关系,题目难度不大.


 导学教程高中新课标系列答案
导学教程高中新课标系列答案科目:高中化学 来源: 题型:实验题
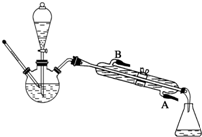 已知乙酸和乙醇在浓硫酸催化下会发生下列反应:
已知乙酸和乙醇在浓硫酸催化下会发生下列反应:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为防止铁生锈,在其表面涂一层防锈油漆 | |
| B. | 为防止火灾,在面粉厂、加油站等场所要严禁烟火 | |
| C. | 为加快KClO3的分解速率,加入MnO2 | |
| D. | 为提高H2O2的分解率,向溶液中滴加FeCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
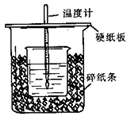 用50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
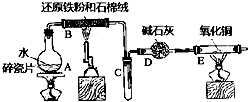 某实验小组利用下图所列装置进行“铁与水蒸气反应”的实验,并利用产物进一步制取FeCl3•6H2O晶体.(图中夹持及尾气处理装置均已略去)
某实验小组利用下图所列装置进行“铁与水蒸气反应”的实验,并利用产物进一步制取FeCl3•6H2O晶体.(图中夹持及尾气处理装置均已略去)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 1000 | 1150 | 1300 |
| 平衡常数 | 64.0 | 50.7 | 42.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在537℃、1.01×105Pa时,往容积可变的密闭容器中充入1mol X和3mol Y,此时容积为V L.保持恒温恒压,发生反应X(g)+3Y(g)?2Z(g),达到平衡时,平衡混合气体中Z的体积分数为0.5.
在537℃、1.01×105Pa时,往容积可变的密闭容器中充入1mol X和3mol Y,此时容积为V L.保持恒温恒压,发生反应X(g)+3Y(g)?2Z(g),达到平衡时,平衡混合气体中Z的体积分数为0.5.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学反应 | 平衡常数 | 温度(℃) | |
| 500 | 800 | ||
| ①2H2(g)+CO(g)?CH3OH(g) | K1 | 2.5 | 0.15 |
| ②H2(g)+CO2(g)?H2O (g)+CO(g) | K2 | 1.0 | 2.50 |
| ③3H2(g)+CO2(g)?CH3OH(g)+H2O (g) | K3 | ||

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com