
| A、溶液中由水电离的氢离子浓度为1×10-11mol/L:K+、Na+、SO42-、NO3- |
| B、使酚酞变红色的溶液:Na+、Cu2+、HCO3-、NO3- |
| C、0.1mol?L-1 AgNO3 溶液:H+、K+、SO42-、I- |
| D、0.1mol?L-1 NaAlO2 溶液:H+、Na+、Cl-、SO42- |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
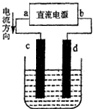 在铁皮上镀一层锌时,可用如图的装置.以下叙述错误的是( )
在铁皮上镀一层锌时,可用如图的装置.以下叙述错误的是( )| A、电镀前,铁皮可用热碱溶液除油渍,盐酸除铁锈 |
| B、c为铁,d为锌 |
| C、用含Zn2+的盐配成电解质溶液 |
| D、电镀时,发生氧化和还原反应的都是锌元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、铜
| ||||
B、铜
| ||||
C、铜
| ||||
D、铜
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH3COO-、Na+、CH3COOH |
| B、CH3COO-、CH3COOH、H+ |
| C、CH3COOH、OH-、H+ |
| D、CH3COO-、OH-、H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氨水的浓度大于盐酸的浓度 |
| B、原氨水中有1%的含氮微粒为NH4+ |
| C、氨水中水电离出的c(H+)是盐酸中水电离出的c(H+)的100倍 |
| D、混合溶液中c(NH4+)+c(NH3?H2O)+c(NH3)=5×10-4mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1mol/L Na2A溶液中存在的粒子浓度关系:c(A2-)+c(HA-)+c(H2A)=0.1mol/L |
| B、0.1mol/L的NaHA溶液中离子浓度为:c(Na+)>c(HA-)>c(A2-)>c(H+)>c(OH-) |
| C、若0.1mol/L的NaHA溶液pH=2.0,则0.1mol/L的H2A溶液中,c(H+)<0.11mol/L |
| D、等物质的量浓度、等体积的H2A和NaOH溶液混合反应后,溶液可能呈中性或碱性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com