
| A.分别向等质量的白色粉末中加等体积适量的水,比较固体溶解量的多少 |
| B.分别配成溶液,加入Ca(OH)2溶液,比较是否有沉淀生成 |
| C.分别配成溶液,做焰色反应,观察火焰的颜色 |
| D.分别将等量的白色粉末用右下图装置进行实验,比较澄清石灰水是否变浑浊 |
 口算能手系列答案
口算能手系列答案科目:高中化学 来源:不详 题型:填空题
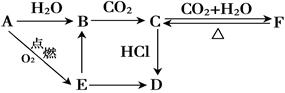
 C: ,
C: , B: ,
B: , F: 。
F: 。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.单质钠的密度比钾的密度小 |
| B.Na+和K+常用作氧化剂 |
| C.钠和钾都是短周期元素 |
| D.钠和钾的合金[ω(K)=50%~80%]在室温下呈液态 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①②⑤ | B.①④⑤ | C.①②③ | D.①②④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①④ | B.①⑤ | C.③④ | D.①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.热稳定性:NaHCO3<Na2CO3 |
| B.在水中的溶解性:NaHCO3<Na2CO3 |
| C.与盐酸反应的速率:NaHCO3<Na2CO3 |
| D.等物质的量的Na2CO3、NaHCO3分别与足量盐酸反应产生的CO2质量相同 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1molCO燃烧时放出的热量为283 kJ?mol-1 |
| B.Na2O2(s)+CO(g) = Na2CO3(s)ΔH= -509 kJ?mol-1 |
| C.Na2O2(s)与CO2(g)反应放出226 kJ热量时电子转移数为2NA |
| D.Na2O2和Na2CO3中阴阳离子个数比不同 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
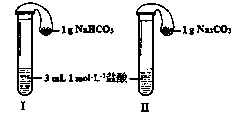
| 实验方案 | 预测现象 | 预测依据 |
| 操作1:向2 mL Na2CO3溶液中滴加1 mL 0.5 mol·L-1CaCl2溶液 | 有白色沉淀 | Na2CO3溶液中的CO32-浓度较大,能与CaCl2发生反应Ca2+ + CO32- = CaCO3↓。 |
| 操作2:向2 mL NaHCO3溶液中滴加1 mL 0.5 mol·L-1CaCl2溶液 | 无白色沉淀 | NaHCO3溶液中的CO32-浓度很小,不能与CaCl2反应。 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.有气体生成 | B.钠融化成小球并在液面上游动 |
| C.溶液底部有银白色的金属钙生成 | D.溶液变浑浊 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com