
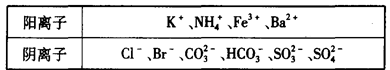

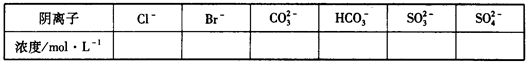
| 阴离子 | Cl- | Br- | CO32- | HCO3- | SO32- | SO42- |
| 浓度/mol·L-1 | ? | 0 | 0.1 | 0.1 | 0 | 0.05 |


科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
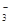 、SO
、SO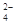 、NH
、NH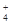 、CO
、CO (不考虑溶液中由水电离的少量的H+和OH-),取200mL该溶液,分为两等份进行下列实验:
(不考虑溶液中由水电离的少量的H+和OH-),取200mL该溶液,分为两等份进行下列实验:查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
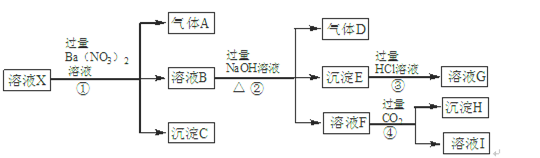
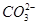 ;⑦
;⑦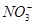 中的几种离子,向该溶液中逐滴加入NaOH溶液至过量,生成沉淀的质量如图所示。则该溶液中一定含有的离子是
中的几种离子,向该溶液中逐滴加入NaOH溶液至过量,生成沉淀的质量如图所示。则该溶液中一定含有的离子是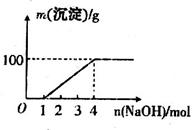
| A.②⑤⑦ | B.②⑤⑥ | C.③⑤⑦ | D.①④⑤ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.一定含SO42- | B.一定含Ag+ | C.可能含SO42- | D.可能含CO32- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.形成较多的白色沉淀 |
| B.形成的沉淀纯度更高 |
| C.排除SO42- 以外的其它阴离子及Ag+的干扰 |
| D.排除Ba2+ 以外的其它阳离子的干扰 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.K+一定存在 |
| B.100 mL溶液中含0.01 mol CO32- |
| C.Cl-一定存在 |
| D.Ba2+一定不存在,Mg2+可能存在 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Cu(OH)2 | B.Cu2(OH)2SO4 |
| C.3Cu(OH)2·CuSO4 | D.Cu(OH)2·3CuSO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com