
分析 (1)W、X各自的氧化物对应的水化物可以反应生成盐和水,可推知W为Na、X为Al;
(2)W(Na)与Y可形成化合物W2Y,Y表现-2价,则Y为S;
(3)结合原子序数可知Z为Cl,S的低价氧化物通入氯气的水溶液中,应为二氧化硫与氯气反应生成硫酸与HCl;
(4)电子层结构相同核电荷数越大离子半径越小,电子层越多离子半径越大,据此判断;
(5)Z为Cl,位于周期表第三周期,第VIIA族.
解答 解:W、X、Y、Z是原子序数依次增大的同一周期元素,原子序数均小于18,W、X是金属元素,Y、Z是非金属元素
(1)W、X为金属,其最高价氧化物对应的水化物为碱,且两种碱可以反应生成盐和水,则为NaOH和Al(OH)3,二者反应的离子方程式:Al(OH)3+OH-=AlO2-+2H2O,
故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(2)W(Na)与Y可形成化合物W2Y,Y表现-2价,则Y为S,形成化合物为Na2S,故答案为:Na2S;
(3)结合原子序数可知Z为Cl,S的低价氧化物通入氯气的水溶液中,应为二氧化硫与氯气反应生成硫酸与HCl,反应化学方程式为SO2+Cl2+2H2O=H2SO4+2HCl,
故答案为:SO2+Cl2+2H2O=H2SO4+2HCl;
(4)电子层结构相同核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径大小顺序是:S 2->Cl->Na+>Al 3+,
故答案为:S 2->Cl->Na+>Al 3+;
(5)Z为Cl,位于周期表第三周期,第VIIA族,故答案为:第三周期,第VIIA族.
点评 本题考查结构性质位置关系应用,为高考常见题型,侧重考查学生的分析能力,题目涉及电子式、半径比较等,正确推断元素是解本题关键,注意掌握微粒半径大小的比较方法,难度不大.


 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案科目:高中化学 来源: 题型:多选题
| 甲 | 乙 | |
| 丙 | 丁 | 戊 |
| A. | 原子半径:丙<丁<戊 | |
| B. | 金属性:甲>乙 | |
| C. | 最外层电子数:甲>乙 | |
| D. | 最高价氧化物的水化物的碱性:丙>丁>戊 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2+2OH-═CO32-+H2O | B. | Al2O3+2OH-+═2 AlO2-+H2O | ||
| C. | Al3++4OH-═AlO2-+2H2O | D. | 2 Al+2OH-+6H2O═2 AlO2-++3 H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原气体中肯定有SO2,可能有HCl | B. | 原气体中肯定没有H2S、HBr和CO2 | ||
| C. | 原气体中肯定有SO2和 HCl | D. | 原气体中肯定没有CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 海水淡化------蒸馏 | |
| B. | 将碘单质从沙子提取出来--------过滤 | |
| C. | 盐水中获得食盐--------萃取分液 | |
| D. | 稀释浓硫酸时将水慢慢加入浓硫酸中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子核内有10个中子的氧原子:${\;}_{\;}^{18}$O | |
| B. | 乙烯的结构简式:CH2CH2 | |
| C. | CH4分子的比例模型: | |
| D. | 乙炔分子的电子式: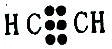 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3气体(H2O):通过浓H2SO4干燥 | |
| B. | FeCl2溶液(FeCl3):加入铁粉,过滤 | |
| C. | CO气体(CO2):通过NaOH溶液洗气后干燥 | |
| D. | Cl2气体(HCl):通过饱和NaCl溶液洗气后干燥 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “水热反应”是一种复杂的化学变化 | |
| B. | 二氧化碳与超临界水作用生成汽油的反应,属于放热反应 | |
| C. | 火力发电厂可望利用废热,将二氧化碳转变为能源物质 | |
| D. | 随着科技的进步,“水热反应”制取能源有望实现地球上碳资源的和谐循环 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com