
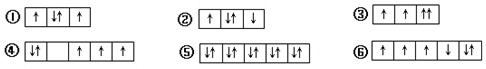
| A. | ①②③ | B. | ④⑤⑥ | C. | ②④⑥ | D. | ③④⑥ |
分析 洪特规则:在同一个电子亚层中排布的电子,总是尽先占据不同的轨道,且自旋方向相同,以此进行判断.
解答 解:①2p能层有4个电子,应在3个不同的轨道,符合洪特规则、泡利不相容原理;
②2p能层有4个电子,图示不同轨道的单电子自旋方向不同,违反了洪特规则;
③2p能层有4个电子,同一个原子轨道中不应有自旋状态相同的电子,违反了泡利原理;
④3d能级中有5个不同的轨道,对于基态原子,电子在能量相同的轨道上排布时,将尽可能分占不同的轨道并且自旋状态相同,违反了洪特规则;
④3d能级中有5个不同的轨道,有10个电子,符合洪特规则、泡利不相容原理;
⑤3d能级中有5个不同的轨道,有6个电子,图示不同轨道的单电子自旋方向不同,违反了洪特规则;
故选:C.
点评 本题考查原子核外电子的排布,题目难度不大,注意泡利原理、洪特规则的内容即可解答该题,学习中注意相关基础知识的积累.


科目:高中化学 来源: 题型:填空题
| 物质类别 | 烯烃 | 酚 | 醛 | 硝基化合物 |
| 官能团名称 | 碳碳双键 | 羟基 | 醛基 | 硝基 |
| 结构简式 |  | -OH | -CHO | -NO2 |
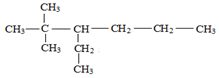 的名称为2,2-二甲基-3-乙基己烷.
的名称为2,2-二甲基-3-乙基己烷.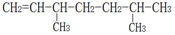 的名称为2,5-二甲基-1-庚烯.
的名称为2,5-二甲基-1-庚烯.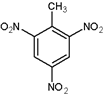 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| NaOH起始读数 | NaOH终点读数 | |
| 第一次 | 0.50mL | 18.60mL |
| 第二次 | 0.70mL | 19.00mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
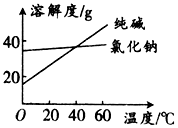 阅读分析下列材料:
阅读分析下列材料:| 物质 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 溶解性 |
| 乙二醇 C2H6O2 | -11.5 | 198 | 1.11 | 易溶于水和乙醇及其他有机溶剂 |
| 丙三醇 C3H8O3 | 17.9 | 290 | 1.26 | 能跟水和酒精以任意比互溶;易溶于其他有机溶剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 沸点/K | 标准状况时在水中的溶解度 | |
| H2S | 202 | 2.6 |
| H2O2 | 423 | 以任意比互溶 |
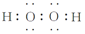
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
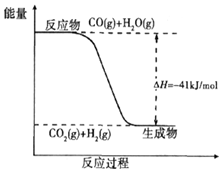 煤炭可以转化为清洁能源和化工原料.
煤炭可以转化为清洁能源和化工原料.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com