
| A、锰、铬都是d区元素 |
| B、锰的未成对电子数比铬的多 |
| C、a>b |
| D、a、b的值取决于铬锰的核外电子排布 |


科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
| 方案 | 操作 | 实验现象及结论 | 结沦是 否可靠 | 判断依据 |
| 甲 | 取少量黄色溶液,加入四氯化碳,振荡、静置. | 下层溶液呈橙红色,证明Br2不能将Fe2+氧化为Fe3+. | ① | ② (填文字) |
| 乙 | 取少量黄色溶液,加入 几滴淀粉碘化钾溶液. | 溶液变为蓝色,证明Br2能 将Fe2+氧化为Fe3+. | ③ | ④ (写离子方程式) |
| 丙 | 取少量黄色溶液,加入 几滴 ⑤ | 溶液变为红色,证明Br2能 将Fe2+氧化为Fe3+. | 可靠 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
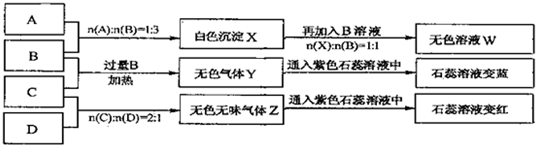
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向某溶液中加入稀盐酸,产生的气体通入澄清石灰水,石灰水变浑浊,该溶液一定是碳酸盐溶液 |
| B、用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色,该溶液不一定是钠盐溶液 |
| C、向某未知溶液中加入稀NaOH溶液,将湿润的红色石蕊试纸靠近试管口,无明显现象,则原溶液中没有NH4+ |
| D、某溶液中加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀,该溶液一定含有Ag+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com