
【题目】高锰酸钾可用于生活消毒,是中学化学常见的氧化剂。工业上,用软锰矿制高锰酸钾的流程如下:

请回答下列问题:
(1)KMnO4稀溶液是一种常用的消毒剂.其消毒原理与下列物质相同的是 (填代号).
a.84消毒液(NaClO溶液) b.双氧水 c.苯酚 d.75%酒精
(2)操作Ⅰ的名称是___________________;操作Ⅱ根据KMnO4和K2CO3两物质在溶解性上的差异,采用________________(填操作步骤)、趁热过滤得到KMnO4粗晶体.
(3)写出二氧化锰和氢氧化钾熔融物中通入空气时发生的主要化学反应的方程式: 。
(4)以惰性材料为电极,采用电解锰酸钾溶液的方法也可制得高锰酸钾,则阳极反应式为 。
(5)测定高锰酸钾样品纯度:向高锰酸钾溶液中滴定硫酸锰溶液,产生黑色沉淀。当溶液由紫红色刚好褪色且半分钟不变色,表明达到滴定终点。写出离子方程式: 。
(6)理论上(若不考虑物质循环与制备过程中的损失)1mol MnO2可制得 mol KMnO4.
【答案】(1)ab(2分) (2)过滤;(2分) 浓缩结晶.(2分)
(3)2MnO2+4KOH+O2![]() 2K2MnO4+2H2O;(2分)
2K2MnO4+2H2O;(2分)
(4)MnO42-—e-=MnO4-;(2分)
(5)2MnO4+3Mn2++2H2O=5MnO2↓+4H+;(2分)
(6)![]() ;(或0.67)(2分)
;(或0.67)(2分)
【解析】
试题分析:(1)KMnO4有强氧化性,利用其强氧化性杀菌消毒,消毒原理与84消毒液、双氧水一样,故选ab;
(2)将KMnO4、K2CO3、MnO2溶于水然后过滤得到KMnO4、K2CO3混合溶液,所以操作Ⅰ为过滤,再根据KMnO4、K2CO3溶解度差异采用浓缩结晶、趁热过滤得到KMnO4粗晶体;
(3)由工艺流程转化关系可知,MnO2、KOH的熔融混合物中通入空气时发生反应生成K2MnO4,根据元素守恒还应生成水.反应中锰元素由+4价升高为+6价,总升高2价,氧元素由0价降低为-2价,总共降低4价,化合价升降最小公倍数为4,所以MnO2系数2,O2系数为1,根据锰元素守恒确定K2MnO4系数为2,根据钾元素守恒确定KOH系数为4,根据氢元素守恒确定H2O系数为2,所以反应化学方程式为2MnO2+4KOH+O2![]() 2K2MnO4+2H2O;
2K2MnO4+2H2O;
(4)以惰性材料为电极,采用电解锰酸钾溶液的方法也可制得高锰酸钾,则阳极发生氧化反应,其电极反应式为MnO42-— e- = MnO4-;
(5)向高锰酸钾溶液中滴加硫酸锰溶液,产生黑色沉淀二氧化锰,反应的离子方程式为2MnO4-+3Mn2++2H2O═5MnO2↓+4H+;
(6)由2MnO2+4KOH+O2![]() 2K2MnO4+2H2O 可知最初的原料中1mol MnO2恰好得到1mol K2MnO4.由3K2MnO4+2CO2=2KMnO4+2K2CO3+MnO2知,1mol K2MnO4在反应中能得到2/3molKMnO4。
2K2MnO4+2H2O 可知最初的原料中1mol MnO2恰好得到1mol K2MnO4.由3K2MnO4+2CO2=2KMnO4+2K2CO3+MnO2知,1mol K2MnO4在反应中能得到2/3molKMnO4。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】氢化铝钠(NaAlH4)是一种新型轻质储氢材料,掺入少量Ti的NaAlH4在150℃时释氢,在170℃、15.2MPa条件下又重复吸氢。NaAlH4可由AlCl3和NaH在适当条件下合成.NaAlH4的晶胞结构如图所示.
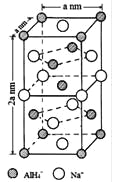
(1)基态Ti原子的价电子轨道表示式为 。
(2)NaH的熔点为800℃,不溶于有机溶剂,NaH属于 晶体,其电子式为 。
(3)AlH4-中,Al的轨道杂化方式为 ;例举与AlH4-空间构型相同的一种离子和一种分子 、 (填化学式)。
(4)NaAlH4晶体中,与AlH4-紧邻且等距的Na+有 个;NaAlH4晶体的密度为 gcm-3(用含a的代数式表示).若NaAlH4晶胞底心处的Na+被Li+取代,得到的晶体为 (填化学式)。
(5)AlCl3在178℃时升华,其蒸气的相对分子质量约为267,分子中有两个配位键,蒸气分子的结构式为 (标明配位键)。
(6)NaAlH4的释氢机理为:每3个AlH4-中,有2个分别释放出3个H原子和1个Al原子,同时与该Al原子最近邻的Na原子转移到被释放的Al原子留下的空位,形成新的结构.这种结构变化由表面层扩展到整个晶体,从而释放出氢气。该释氢过程可用化学方程式表示为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某铁矿石(若只含铁的氧化物和SiO2)取36g溶于过量的稀盐酸中,过滤、洗涤、干燥后得5.6g不溶物,向得到的滤液中加入足量的NaOH溶液,过滤、洗涤后将沉淀灼烧,得32g红棕色固体.根据题意下列结论不正确的是( )
A. 由铁矿石转化为红棕色固体的过程中发生了氧化还原反应
B. 溶于盐酸后得到的滤液中n(Fe2+):n(Fe3+)=1:1
C. 铁矿石中的铁的氧化物的化学式一定是Fe3O4
D. 若稀盐酸为3.0molL﹣1 400mL,反应前后体积变化忽略不计,则滤液中剩余H+的物质的量浓度是0.5molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作中错误的是
A. 过滤操作时,如果有必要可以用蒸馏水洗涤滤纸上的沉淀2-3次
B. 蒸馏操作时,应使温度计水银球插入液态混合物中
C. 分液操作时,分液漏斗中下层液体从下口放出,上层液休从上口倒出
D. 萃取操作时,萃取剂要和原溶液互不相容,且不能与溶质和溶剂反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于密闭容器中可逆反应 A2(g)+3B2(g)![]() 2AB3(g),探究单一条件改变情况下,可能引起平衡状态的改变,得到如下图所示的曲线(图中T表示温度,n 表示物质的量)下列判断正确的是( )
2AB3(g),探究单一条件改变情况下,可能引起平衡状态的改变,得到如下图所示的曲线(图中T表示温度,n 表示物质的量)下列判断正确的是( )

A.加入催化剂可以使状态 d 变为状态 b
B.若 T1>T2,则逆反应一定是放热反应
C.达到平衡时 A2 的转化率大小为: b>a>c
D.在T2 和n(A2)不变时达到平衡,AB3 的物质的量大小为: c>b>a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法或操作中,正确的有( )
①标准状况下,1 mol溴单质的体积约为22.4 L ②用托盘天平称量50.56 g KCl固体 ③用酒精从饱和碘水中萃取碘
④让一束光通过胶体,从垂直于光线的方向可以看到一条光亮的“通路” ⑤从含有少量氯化钠的硝酸钾溶液中提取硝酸钾可用结晶的方法
A. 1个 B. 2个
C. 3个 D. 4个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
A. 2,2-二甲基丁烷与2,4-二甲基戊烷的一氯代物种类数相同
B. 乙烷、苯、裂化汽油溶液均不能使酸性高锰酸钾溶液褪色
C. 苯的密度比水小,但由苯反应制得的溴苯、硝基苯、环已烷的密度都比水大
D. 乙酸乙酯在碱性条件下的水解反应称为皂化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下的2L密闭容器,进行反应2X(g)+Y(g) ![]() 2Z(g),若起始时X、Y、Z物质的量分别为n1、n2、n3(均不为零)。达平衡时,X、Y、Z浓度分别为0.2mol/L、0.1 mol /L和0.08 mol/L,则下列判断合理的是( )
2Z(g),若起始时X、Y、Z物质的量分别为n1、n2、n3(均不为零)。达平衡时,X、Y、Z浓度分别为0.2mol/L、0.1 mol /L和0.08 mol/L,则下列判断合理的是( )
A. X和Y的转化率不一定相等
B. n1、n2=2:1
C. 平衡时,Y和Z的生成速率之比为2:1
D. n1的取值范围为0<n1<0.28
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com