
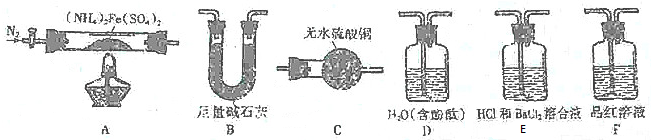
分析 (1)实验I验证分解产物中含有氨气和水蒸气,选择装置A先通入氮气排净装置中的空气,加热分解硫酸亚铁铵,分解产物中含有铁氧化物、硫氧化物、氨气和水蒸气等,通过装置C中无水硫酸铜检验生成的水,再通过装置B中的足量碱石灰除去水蒸气、硫的氧化物,通过装置D检验氨气的生成,通入后溶液变红色说明生成气体中含氨气;
(2)证明水蒸气生成是利用无水硫酸铜遇到水变蓝色;
(3)证明有氨气生成是利用氨气极易溶于水生成一水合氨溶液显碱性使酚酞变红色;
(4)设计实验利用亚铁离子具有还原性可以使酸性高锰酸钾溶液褪色设计;
(5)E中没有明显现象,说明无三氧化硫生成,F中溶液褪色说明有二氧化硫生成;
(6)最后装置B是防止二氧化硫污染空气;
(7)实验证明(NH4)2Fe(SO4)2受热分解生成氨气、二氧化硫、氧化铁、水,还有N2产生,结合原子守恒和电子守恒配平书写化学方程式.
解答 解:(1)实验I验证分解产物中含有氨气和水蒸气,选择装置A先通入氮气排净装置中的空气,加热分解硫酸亚铁铵,分解产物中含有铁氧化物、硫氧化物、氨气和水蒸气等,通过装置C中无水硫酸铜检验生成的水,再通过装置B中的足量碱石灰除去水蒸气、硫的氧化物,通过装置D检验氨气的生成,通入后溶液变红色说明生成气体中含氨气,所选用装置的正确连接顺序为ACBD,
故答案为:ACBD;
(2)利用无水硫酸铜遇到水变蓝色证明水蒸气生成,证明有水蒸气生成的实验现象为C中无水硫酸铜变蓝色,
故答案为:C中无水硫酸铜变蓝色;
(3)证明有氨气生成是利用氨气极易溶于水生成一水合氨,溶液显碱性使酚酞变红色,证明有氨气生成的实验现象为D中溶液变红色,
故答案为:D中溶液变红色;
(4)设计实验证明A中残留固体仅为Fe2O3,而不含FeO或Fe3O4,设计实验利用亚铁离子具有还原性可以使酸性高锰酸钾溶液褪色设计,取少量A中残留固体加入适量稀硫酸使其完全溶解,向溶液中滴加少量酸性高锰酸钾溶液,若高锰酸钾溶液不褪色,则残留固体是Fe2O3而不含FeO和Fe3O4,
故答案为:取少量A中残留固体加入适量稀硫酸使其完全溶解,向溶液中滴加少量酸性高锰酸钾溶液,若高锰酸钾溶液不褪色,则残留固体是Fe2O3而不含FeO和Fe3O4;
(5)E中含HCl的BaCl2溶液没有明显现象,说明无硫酸钡沉淀生成,证明分解产物中无三氧化硫生成,二氧化硫具有漂白性能使品红溶液褪色,F中溶液褪色说明有二氧化硫生成,
故答案为:分解产物中有SO2没有SO3;
(6)连接装置A-E-F-B进行实验,最后装置B是防止二氧化硫污染空气,
故答案为:吸收SO2防止污染空气;
(7)实验证明(NH4)2Fe(SO4)2受热分解生成氨气、二氧化硫、氧化铁、水,还有N2产生,结合原子守恒和电子守恒配平书写化学方程式为:2(NH4)2Fe(SO4)2$\frac{\underline{\;500℃\;}}{\;}$Fe2O3+4SO2↑+2NH3↑+N2↑+5H2O,
故答案为:2(NH4)2Fe(SO4)2$\frac{\underline{\;500℃\;}}{\;}$Fe2O3+4SO2↑+2NH3↑+N2↑+5H2O.
点评 本题考查了物质组成的实验探究和实验设计,主要是实验基本操作、物质性质的理解应用,掌握基础是解题关键,题目难度中等.


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:选择题
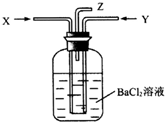 碳跟浓硫酸共热产生的混合气体X(CO2、SO2)和铜跟过量浓硝酸反应产生的气体Y(NO2)同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列有关说法正确的是( )
碳跟浓硫酸共热产生的混合气体X(CO2、SO2)和铜跟过量浓硝酸反应产生的气体Y(NO2)同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列有关说法正确的是( )| A. | 洗气瓶中产生的沉淀是碳酸钡 | B. | 在Z导管出来的气体中无二氧化碳 | ||
| C. | 在Z导管口不会出现红棕色气体 | D. | 洗气瓶中产生的沉淀是硫酸钡 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl的水溶液是强酸,HBr的水溶液也是强酸 | |
| B. | CO2气体通入Ba(NO3)2溶液中不反应,SO2气体通入Ba(NO3)2溶液中也不反应 | |
| C. | O2与Cu反应生成CuO,S与Cu反应生成CuS | |
| D. | CaCO3与稀硝酸反应生成CO2,CaSO3与稀硝酸反应生成SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③⑤ | B. | ③④⑤ | C. | ②④⑤ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两种粒子,若核外电子排布完全相同,则其化学性质一定相同 | |
| B. | 离子化合物中,一定存在金属元素和非金属元素 | |
| C. | 同时含有离子键和共价键的化合物,一定是离子化合物,不可能是共价化合物 | |
| D. | 难失电子的原子,获得电子的能力一定强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
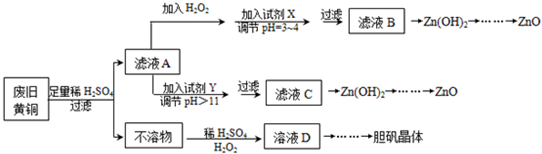
| Fe3+ | Fe2+ | Zn2+ | |
| 开始沉淀的pH | 1.1 | 5.8 | |
| 沉淀完全的pH | 3.0 | 8.8 | 8.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
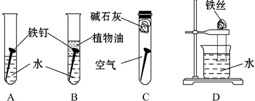 某研究性学习小组对铁生锈进行研究.
某研究性学习小组对铁生锈进行研究.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com