
有五个系列的同族元素的物质,101.3 kPa时测定的沸点(℃)如下表所示:
① | He-268.8 | (a)-249.5 | Ar-185.8 | Kr-151.7 |
② | F2-187.0 | Cl2-33.6 | (b)5.7 | I2184.0 |
③ | (c)19.4 | HCl-84.0 | HBr-67.0 | HI-35.5 |
④ | H2O100.0 | H2S-60.0 | (d)-42.0 | H2Te-1.8 |
⑤ | CH4-161.0 | SiH4-112.0 | GeH4-90.0 | (e)-52.0 |
对应表中内容,下列叙述中不正确的是( )
A.a、b、e的化学式分别为Ne、Br2、SnH4
B.系列②物质均有氧化性,系列③物质对应水溶液均是强酸
C.系列④中各化合物的稳定性顺序为:H2O>H2S>(d)>H2Te
D.上表内的物质(c)和H2O,由于氢键的影响,其熔沸点在同族中特别高
科目:高中化学 来源:2015-2016学年河北省邯郸市大名等四县高二下学期期中联考化学试卷(解析版) 题型:选择题
下列实验中,所使用的装置(夹持装置略)、试剂和操作都正确的是( )
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北省黄石市高一下学期期中考试化学试卷(解析版) 题型:选择题
甲、乙是周期表中同一主族的两种元素,若甲的原子序数为x,则乙的原子序数不可能为( ) ①x+2 ②x+4 ③x+8 ④x+18 ⑤x+32
A.①⑤ B.② C.③ D.④
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北省黄石市高二下学期期中考试化学试卷(解析版) 题型:填空题
A、B、C、D、E、F分别代表原子序数依次增大的短周期元素。A和D属同族元素;B和F位于第VIIA族;A和B可形成化合物AB4;C基态原子的s轨道和p轨道的电子总数相等;E的一种单质在空气中能够自燃。 请回答下列问题:
(1)D基态原子的电子排布式是_____________________。
(2)利用价层电子对互斥理论判断EF3的立体构型是______。
(3)A所在周期元素最高价氧化物对应的水化物中,酸性最强的是______(填化学式);B和F的氢化物中沸点较高的是_____(填化学式);C、D、F的单质形成的晶体,熔点由高到低的排列顺序是_______(填化学式)。
(4)CuSO4溶液能用作E4中毒的解毒剂,反应可生成E的最高价含氧酸和铜,该反应的化学方程式是_______________________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北省黄石市高二下学期期中考试化学试卷(解析版) 题型:选择题
有关晶体的下列说法中正确的是( )
A.分子晶体中共价键越强,熔点越高 B.原子晶体中分子间作用力越强,熔点越高
C.氯化钠晶体熔化时离子键发生断裂 D.金属晶体熔化时金属键未发生断裂
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北省黄石市高二下学期期中考试化学试卷(解析版) 题型:选择题
人们把食品分为绿色食品、蓝色食品、白色食品等.绿色植物通过光合作用转化的食品叫绿色食品,海洋提供的叫蓝色食品,通过微生物发酵制得的食品叫白色食品.下面属于白色食品的是
A.菜油 B.面粉 C.海带 D.酱油
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北省高二下学期期中考试化学试卷(解析版) 题型:选择题
有机物的结构可用“键线式”表示,如:CH3CH=CHCH3可简写为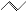 。有机物X的键线式为
。有机物X的键线式为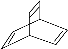 ,下列说法正确的是( )
,下列说法正确的是( )
A.X的化学式为C8H10
B.有机物Y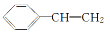 与X互为同系物
与X互为同系物
C.X因发生加成反应而使酸性高锰酸钾溶液褪色
D.X与足量的H2在一定条件下反应可生成环状烃Z,Z的一氯代物有2种
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河南省周口市高二下学期期中考试化学试卷(解析版) 题型:填空题
乙二醇(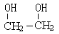 )是一种重要的化工原料,
)是一种重要的化工原料,
Ⅰ.在一定条件下以CO和H2为原料可以合成乙二醇,反应方程式如下:
2CO(g)+3H2(g) 
 (g) ΔH= a kJ/mol
(g) ΔH= a kJ/mol
(1)该反应能够自发进行,可以推出a 0;(填“>”“<”或“=”)。
(2)在一定温度下,向体积为1L的恒容密闭容器中充入2 mol CO (g)和3mol H2(g),压强为P1,达到平衡时压强变为P2,且P1:P2=15:7,则该温度下的化学平衡常数K=______
(3)只改变反应的一个条件,能使平衡体系中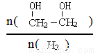 增大的措施有 (写两条)
增大的措施有 (写两条)
Ⅱ.乙二醇经连续催化氧化后可得到乙二酸(HOOC-COOH),乙二酸俗称草酸,分子式可以用H2C2O4表示,H2C2O4是一种二元弱酸,常温下其电离平衡常数K1=5.0×10-2,K2=5.0×10-5
(1)H2C2O4的电离方程式为 。
(2)Na2C2O4溶液显 (填“酸性”、“中性”或“碱性”),溶液中各离子浓度从大到小的顺序为 。
(3)已知常温下NH3·H2O的电离平衡常数K=1.75×10-5,常温下,
反应NH3·H2O + HC2O4-  NH4+ +C2O42-+H2O的平衡常数K= 。
NH4+ +C2O42-+H2O的平衡常数K= 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广东汕头金山中学高二下第十二周练化学卷(解析版) 题型:选择题
在乙烯分子中有5个σ键、一个π键,它们分别是
A.sp2杂化轨道形成σ键、未杂化的2p轨道形成π键
B.sp2杂化轨道形成π键、未杂化的2p轨道形成σ键
C.C-H之间是sp2形成的σ键,C-C之间是未参加杂化的2p轨道形成的π键
D.C-C之间是sp2形成的σ键,C-H之间是未参加杂化的2p轨道形成的π键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com