
【题目】氟在自然界中常以CaF2的形式存在.
(1)下列关于CaF2的表述正确的是 .
a.Ca2+与F﹣间仅存在静电吸引作用
b.F﹣的离子半径小于Cl﹣ , 则CaF2的熔点高于CaCl2
c.阴阳离子比为2:1的物质,均与CaF2晶体构型相同
d.CaF2中的化学键为离子键,因此CaF2在熔融状态下能导电
(2)CaF2难溶于水,但可溶于含Al3+的溶液中,原因是(用离子方程式表示).
已知AlF63﹣在溶液中可稳定存在.
(3)F2通入稀NaOH溶液中可生成OF2 , OF2分子构型为 , 其中氧原子的杂化方式为
(4)F2与其他卤素单质反应可以形成卤素互化物,例如ClF3、BrF3等.已知反应Cl2(g)+3F2(g)═2ClF3(g)△H=﹣313kJmol﹣1 , F﹣F键的键能为159kJmol﹣1 , Cl﹣Cl键的键能为242kJmol﹣1 , 则ClF3中Cl﹣F键的平均键能为kJmol﹣1 . ClF3的熔、沸点比BrF3的(填“高”或“低”).
【答案】
(1)bd
(2)3CaF2+Al3+=3Ca2++AlF63﹣
(3)V形;sp3
(4)172;低
【解析】解:(1)a.阴阳离子间存在静电引力和静电斥力,Ca2+与F﹣间存在静电吸引作用,还存在静电斥力,故a错误;b.离子晶体的熔点与离子所带电荷、离子半径有关,离子半径越小,离子晶体的熔点越高,所以CaF2的熔点高于CaCl2 , 故b正确;
c.晶体的结构与电荷比、半径比有关,阴阳离子比为2:1的物质,与CaF2晶体的电荷比相同,若半径比相差较大,则晶体构型不相同,故c错误;
d.CaF2中的化学键为离子键,离子化合物在熔融时能发生电离,存在自由移动的离子,能导电,因此CaF2在熔融状态下能导电,故b正确;
所以答案是:bd;(2)CaF2难溶于水,但可溶于含Al3+的溶液中,因为在溶液中F﹣与Al3+能形成很难电离的配离子AlF63﹣ , 使CaF2的溶解平衡正移,其反应的离子方程式为:3CaF2+Al3+=3Ca2++AlF63﹣;
所以答案是:3CaF2+Al3+=3Ca2++AlF63﹣;(3)OF2分子中O原子的价层电子对数=2+ ![]() (6﹣2×1)=4,则O原子的杂化类型为sp3杂化,含有2个孤电子对,所以分子的空间构型为V形;
(6﹣2×1)=4,则O原子的杂化类型为sp3杂化,含有2个孤电子对,所以分子的空间构型为V形;
所以答案是:V形;sp3;(4)△H=反应物的总键能﹣生成物的总键能,设Cl﹣F键的平均键能为QkJmol﹣1 ,
则242+159×3﹣2×3×Q=﹣313,解得Q=172;
相对分子质量越大,分子晶体的熔沸点越高,已知ClF3的相对分子质量比BrF3的小,所以ClF3的熔、沸点比BrF3的低;
所以答案是:172;低.
【考点精析】掌握晶体的类型与物质熔点、硬度、导电性等的关系是解答本题的根本,需要知道不同晶体类型的物质:原子晶体>离子晶体>分子晶体;同种晶体类型的物质:晶体内微粒间的作用力越大,溶、沸点越高.


科目:高中化学 来源: 题型:
【题目】进行过滤操作应选用的一组仪器是( )
A. 滤纸、烧杯、试管夹、漏斗、玻璃棒
B. 烧杯、酒精灯、试管、漏斗
C. 漏斗、玻璃棒、烧杯、铁架台、滤纸
D. 玻璃棒、滤纸、烧瓶、漏斗、铁架台
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是某儿童微量元素体检报告单的部分数据:
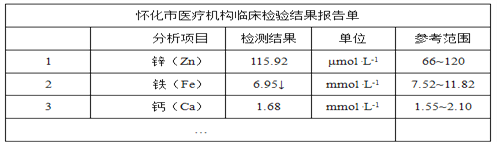
根据上表的数据,回答下列问题:
(1)该儿童__元素含量偏低。
(2)报告单中“μmol·L-1”是__(填“质量” “体积”或“浓度”)的单位。
(3)服用维生素C可使食物中的Fe3+转化为Fe2+。在这个过程中维生素C表现出__________(填“氧化性”或“还原性”)。
(4)硫酸亚铁晶体(FeSO47H2O)在医疗上可作补血剂。某课外小组测定该补血剂(每片b克)中铁元素的含量。实验步骤如图:
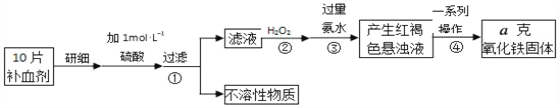
请回答下列问题:
a.②中H2O2的作用是__。
b.④中一系列处理的操作步骤为过滤、______、灼烧、冷却、称量。
c. 下列操作会导致所测定的铁元素含量偏高的是__。
A.步骤③所加氨水量不足 B.步骤④洗涤不充分 C.步骤④灼烧不充分
d. 写出步骤③中发生的离子方程式_____________________________________
e、简述滤液中存在Fe3+的检验方法是:_______________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】3.6g碳在一定量的氧气中燃烧,反应后生成的混合气体相对氢气的密度是16,则生成的一氧化碳的质量是(相对密度指在相同的温度和压强下物质的密度之比)
A. 3.3 g B. 6.3 g C. 8.4 g D. 13.2 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、Q、E五种元素中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,Q的核电荷数是X与Z的核电荷数之和,E在元素周期表的各元素中电负性最大.请回答下列问题:
(1)X的原子结构示意图为;Y的价电子轨道表示式为 .
(2)XZ2与YZ2分子的立体结构分别是和 , 相同条件下两者在水中的溶解度较大的是(写分子式),理由是 .
(3)Q的元素符号是 , 它属于第周期族,它的核外电子排布式为 , 在形成化合物时它的最高化合价为
(4)用氢键表示式写出E的氢化物水溶液中存在的所有氢键 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子,在溶液中能大量共存,加入H2SO4溶液后既有气体放出又有沉淀生成的一组是( )
A.Ba2+、NO ![]() 、NH
、NH ![]() 、Cl﹣
、Cl﹣
B.Ba2+、HCO ![]() 、NH
、NH ![]() 、NO
、NO ![]()
C.K+、Cu2+、Cl﹣、OH﹣
D.Na+、CO ![]() 、SO
、SO ![]() 、K+
、K+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是(NA为阿伏加德罗常数的值) ( )
A. 硫酸的摩尔质量是98 g
B. 1molO2的质量是32g/mol
C. 2g氢气所含原子数目为2NA
D. 标准状况下,11.2LCH4的物质的量为0.5mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E均为短周期主族元素,其原子序数依次增大。其中A元素原子核内只有一个质子;A与C、B与D分别同主族;B、D两元素原子序数之和是A、C两元素原子序数之和的2倍。
请回答下列问题:
(1)由上述元素组成的下列物质中属于非电解质的是________(填字母)。
A.C2B2 B.DB2 C.E2 D.C2DB3
(2)D元素在元素周期表中的位置为_______________________________;化合物C2B中两种离子的半径大小关系为________>________(填离子符号)。
(3)实验室中欲选用下列装置制取并收集纯净干燥的E2气体。实验中应选用的装置为________________(按由左到右的连接顺序填写);
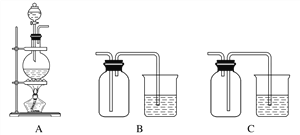
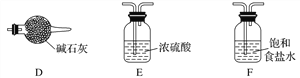
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在溶液中能大量共存,加入OH﹣有沉淀析出,加入H+能放出气体的是( )
A.Na+、C1﹣、NO ![]() 、H+?
、H+?
B.K+、Cl﹣、SO ![]() 、H
、H
C.Fe3+、C1﹣、SO ![]() 、NH
、NH ![]()
D.Ca2+、HCO ![]() 、Cl﹣、NO
、Cl﹣、NO ![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com