
| A. | 除去镁粉中混有的少量铝粉,可加入过量的氢氧化钠溶液,完全反应后过滤 | |
| B. | 用明矾净水是因为Al3+水解生成的胶状Al(OH)3具有很强的吸附性 | |
| C. | 在相同浓度的盐酸中,纯铁比含碳量较高的生铁反应速率快 | |
| D. | 冶金工业中可以利用铝热反应原理冶炼钒、铬、锰等金属 |
分析 A.Al与NaOH溶液反应,而Mg不能;
B.Al3+水解生成的具有吸附性的胶体;
C.生铁与盐酸反应时构成原电池;
D.铝热反应可冶炼熔点高的金属.
解答 解:A.Al与NaOH溶液反应,而Mg不能,则加入过量的氢氧化钠溶液,完全反应后过滤可除杂,故A正确;
B.Al3+水解生成的具有吸附性的胶体,可用于净化水,故B正确;
C.生铁与盐酸反应时构成原电池,则反应速率比纯铁与盐酸反应快,故C错误;
D.铝热反应可冶炼熔点高的金属,则冶金工业中可以利用铝热反应原理冶炼钒、铬、锰等金属,故D正确;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、混合物分离提纯、原电池、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
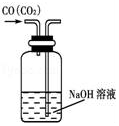 | 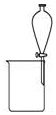 | 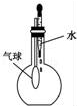 | 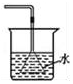 |
| A.除去CO气体中的CO2气体 | B.分离碘酒中的碘和酒精 | C.验证NH3的溶解性 | D.吸收HCl防倒吸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2+H2O═H2CO3 | B. | CO+CuO═Cu+CO2 | ||
| C. | 2H2O═2H2↑+O2↑ | D. | FeS+H2SO4═FeSO4+H2S↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | C=O(CO2) | C=O(COS) | C=S | H-S | H-O |
| 键能(kJ/mol) | 803 | 742 | 577 | 339 | 465 |
| Cl2的体积(标准状况) | 2.8L | 5.6L | 11.2L |
| n(Cl-) | 1.25mol | 1.5mol | 2mol |
| n(Br-) | 1.5mol | 1.4mol | 0.9mol |
| n(I-) | amol | 0 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质名称 | 醋酸 | 氢氰酸 | 氢氟酸 | 甲酸 |
| 电离常数K | 1.75×10-5 | 4.93×10-10 | 7.2×10-4 | 1.77×10-4 |
| A. | 醋酸 | B. | 氢氰酸 | C. | 氢氟酸 | D. | 甲酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不粘锅的原料 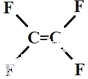 为烃类化合物 为烃类化合物 | |
| B. | 分子组成相差1个或若干个“CH2”原子团的有机物,互称为同系物 | |
| C. | 石油分馏是物理变化,煤的气化、液化是化学变化 | |
| D. | 聚乙烯塑料袋因有毒,不可以装食品 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盐酸 | B. | 醋酸 | C. | 氢氰酸 | D. | 硫酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com