
| A、H3PO2中,P元素的化合价为+1价 |
| B、在溶液中Ag+氧化H3PO2为H3PO4时,氧化剂与还原剂的物质的量之比为4:1 |
| C、次磷酸在水中的电离方程式为H3PO2?H++H2PO2- |
| D、NaH2PO2属于酸式盐 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、过氧化钠可用作潜水艇供氧剂 |
| B、氧化铝是一种耐火材料,可制耐高温实验材料 |
| C、氧化铁可用作红色油漆和涂料 |
| D、氢氧化铝、苏打等可用于治疗胃酸过多 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、C.用0.2000 mol/L NaOH标准溶液滴定HCl与CH3COOH的混合溶液(混合液中两种酸的浓度均约为0.1 mol/L),至中性时,溶液中的酸未被完全中和 |
| B、常温下,反应2A (s)+B (g)=2C (g)+D (g)不能自发进行,则该反应△H一定大于0 |
| C、N2(g)+3H2(g)?2NH3(g)△H<0,其他条件不变时升高温度,反应速率v(H2)和H2的平衡转化率均增大 |
| D、水的离子积常数Kw随着温度的升高而增大,说明水的电离是放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、100 mL 3.0 mol?L-1NaCl溶液 |
| B、75mL 1.0 mol?L-1CaCl2溶液 |
| C、150 mL 1.0mol?L-1KCl溶液 |
| D、100 mL 0.5 mol?L-1AlCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
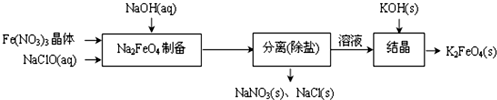
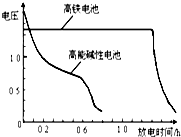
查看答案和解析>>
科目:高中化学 来源: 题型:
A、
| ||
B、
| ||
C、
| ||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,22.4L水的分子数为NA |
| B、常温下将23gNa投入到0.5L1.0mol?L-1的盐酸中反应共转移的电子数为0.5NA |
| C、0.5mol/LKCl溶液中含有0.5NA个K+ |
| D、12.0g熔融的NaHSO4中含有0.1NA个阳离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com