
·ÖĪö £Ø1£©ÅØĮņĖįŌöÖŲµÄĪŖĖ®µÄÖŹĮ棬n£ØH2O£©=$\frac{4.5g}{18g/mol}$=0.25mol£¬n£ØH£©=2n£ØH2O£©=2”Į0.25mol=0.5mol£¬
¼īŹÆ»ŅŌöÖŲĪŖ¶žŃõ»ÆĢ¼µÄÖŹĮ棬n£ØCO2£©=$\frac{8.8g}{44g/mol}$=0.2mol£¬Ōņn£ØC£©=n£ØCO2£©=0.2mol£¬
¹Ź·Ö×ÓÖŠN£ØC£©=$\frac{0.2mol}{0.05mol}$=4”¢N£ØH£©=$\frac{0.5mol}{0.05mol}$=10£¬¹Ź·Ö×ÓŹ½ĪŖC4H10£»
£Ø2£©¶”ĶéÓŠÕż¶”Ķ锢Ņģ¶”ĶéĮ½ÖÖĶ¬·ÖŅģ¹¹Ģ壻
£Ø3£©øł¾ŻµČŠ§Ēā½ųŠŠÅŠ¶Ļ£»
£Ø4£©Éś³ÉµÄĖ®ĪŖĘųĢ壬·“Ó¦Ē°ŗóĘųĢåĢå»ż²»±ä£¬ŌņĢž·Ö×ÓÖŠHŌ×ÓŹżÄæĪŖ4£®
½ā“š ½ā£ŗ£Ø1£©ÅØĮņĖįŌöÖŲµÄĪŖĖ®µÄÖŹĮ棬n£ØH2O£©=$\frac{4.5g}{18g/mol}$=0.25mol£¬n£ØH£©=2n£ØH2O£©=2”Į0.25mol=0.5mol£¬
¼īŹÆ»ŅŌöÖŲĪŖ¶žŃõ»ÆĢ¼µÄÖŹĮ棬n£ØCO2£©=$\frac{8.8g}{44g/mol}$=0.2mol£¬Ōņn£ØC£©=n£ØCO2£©=0.2mol£¬
¹Ź·Ö×ÓÖŠN£ØC£©=$\frac{0.2mol}{0.05mol}$=4”¢N£ØH£©=$\frac{0.5mol}{0.05mol}$=10£¬¹Ź·Ö×ÓŹ½ĪŖC4H10£¬
¹Ź“š°øĪŖ£ŗC4H10£»
£Ø2£©øĆÓŠ»śĪļĪŖ¶”Ķ飬øł¾ŻĢ¼Į“Ņģ¹¹æɵĆC4H10µÄ½į¹¹¼ņŹ½ĪŖ£ŗCH3CH2CH2CH3”¢CH£ØCH3£©3£¬
¹Ź“š°øĪŖ£ŗCH3CH2CH2CH3”¢CH£ØCH3£©3£»
£Ø3£©CH3CH2CH2CH3ÖŠÓŠ2ÖÖHŌ×Ó£¬ĘäŅ»ĀČ“śĪļÓŠ2ÖÖ£¬CH£ØCH3£©3ÖŠÓŠ2ÖÖHŌ×Ó£¬ĘäŅ»ĀČ“śĪļÓŠ2ÖÖ£¬¹Ź¹²ÓŠ4ÖÖ£¬
¹Ź“š°øĪŖ£ŗ4£»
£Ø4£©Éś³ÉµÄĖ®ĪŖĘųĢ壬·“Ó¦Ē°ŗóĘųĢåĢå»ż²»±ä£¬ÓÉCxHy+£Øx+$\frac{y}{4}$£©O2=xCO2+$\frac{y}{2}$H2O£¬Ōņ1+x+$\frac{y}{4}$=x+$\frac{y}{2}$£¬½āµĆx=4£¬¼“Ģž·Ö×ÓÖŠHŌ×ÓŹżÄæĪŖ4£¬¹ŹŃ”ĻīÖŠCH4”¢C2H4 ·ūŗĻ£¬
¹ŹŃ”£ŗAC£®
µćĘĄ ±¾Ģāæ¼²éÓŠ»śĪļ·Ö×ÓŹ½Č·¶Ø”¢Ķ¬·ÖŅģ¹¹Ģ唢ĢžČ¼ÉÕ¹ęĀÉµČ£¬×¢ŅāÕĘĪÕČ¼ÉÕ·ØĄūÓĆŌ×ÓŹŲŗćČ·¶Ø·Ö×ÓŹ½£¬ÄŃ¶Č²»“ó£®


 ĆūŠ£æĪĢĆĻµĮŠ“š°ø
ĆūŠ£æĪĢĆĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 5.6g | B£® | 2.8 g | C£® | 11.2g | D£® | ĪŽ·Ø¼ĘĖć |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
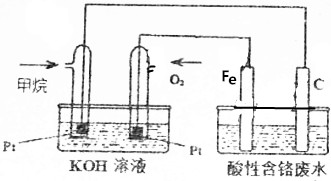
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | æĻ¶ØÓŠAl3+”¢Mg2+”¢NO3-£¬æÉÄÜÓŠNH4+”¢K+ | |
| B£® | æĻ¶ØÓŠAl3+”¢K+”¢Cl-£¬æĻ¶ØƻӊMnO4-”¢Mg2+ | |
| C£® | æĻ¶ØÓŠAl3+”¢NH4+”¢Cl-”¢NO3-£¬Ņ»¶ØƻӊHCO3-”¢Mg2+”¢MnO4- | |
| D£® | øĆČÜŅŗæÉÄÜĻŌČõĖįŠŌ£¬Ņ²æÉÄÜĻŌÖŠŠŌ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | CH4 | B£® | C2H4 | C£® | C2H6 | D£® | C6H8 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ¶ąŃ”Ģā
| ČŻĘ÷ | ¼× | ŅŅ | ±ū |
| ·“Ó¦ĪļĶ¶ČėĮæ | 3mol A”¢2mol B | 6mol A”¢4mol B | 2mol C |
| µ½“ļĘ½ŗāµÄŹ±¼ä£Ømin£© | 5 | 8 | |
| AµÄÅØ¶Č£Ømol/L£© | c1 | c2 | |
| CµÄĢå»ż·ÖŹż | w1 | w3 | |
| »ģŗĻĘųĢåĆÜ¶Č£Øg/L£© | ¦Ń1 | ¦Ń2 |
| A£® | Čōx£¼4£¬Ōņ2c1£¾c2 | |
| B£® | Čōx=4£¬Ōņw3=w1 | |
| C£® | ĪŽĀŪxµÄÖµŹĒ¶ąÉŁ£¬¾łÓŠ2¦Ń1=¦Ń2 | |
| D£® | ČŻĘ÷¼×“ļµ½Ę½ŗāĖłŠčµÄŹ±¼ä±ČČŻĘ÷ŅŅ“ļµ½Ę½ŗāĖłŠčµÄŹ±¼ä¶Ģ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 25”ꏱČō1 mL pH=1µÄŃĪĖįÓė100 mL °±Ė®ČÜŅŗ»ģŗĻŗó£¬ČÜŅŗµÄpH=7£¬Ōņ°±Ė®ČÜŅŗµÄpH=11 | |
| B£® | ½«0.2 mol•L-1ŃĪĖįÓė0.1 mol•L-1µÄKAlO2ČÜŅŗµČĢå»ż»ģŗĻ£¬ČÜŅŗÖŠĄė×ÓÅضČÓÉŠ”µ½“óµÄĖ³Šņ£ŗc£ØOH-£©£¼c£ØH+£©£¼c£ØAl3+£©£¼c£ØK+£©£¼c£ØCl-£© | |
| C£® | pHĻąµČµÄ¢ŁNH4Cl ¢Ś£ØNH4£©2SO4 ¢ŪNH4HSO4ČÜŅŗ£ŗc£ØNH4+£©“óŠ”Ė³ŠņĪŖ¢Ś£¾¢Ł£¾¢Ū | |
| D£® | 0.1mol/LNaHCO3ČÜŅŗÓė0.1mol/LNaOHČÜŅŗµČĢå»ż»ģŗĻ£¬ĖłµĆČÜŅŗÖŠ£ŗc£ØNa+£©+c£ØH+£©=c£ØHCO3-£©+c£ØCO32-£©+c£ØOH-£© |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | NaŗĶO2 | B£® | NaOHČÜŅŗŗĶAlCl3ČÜŅŗ | ||
| C£® | FeŗĶCl2 | D£® | NaOHČÜŅŗŗĶCO2 |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com