
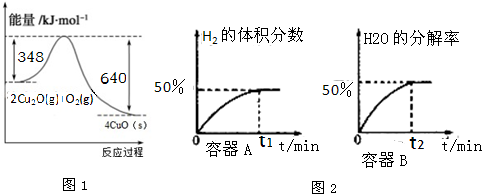
分析 (1)已知:①CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3kJ•mol-1
②N2(g)+O2(g)═2NO(g)△H=+180kJ•mol-1
根据盖斯定律:①-2×②得CH4(g)+4NO(g)═CO2(g)+2N2(g)+2H2O(l),据此计算;
(2)该反应是反应前后气体体积减小的、放热的可逆反应,要提高二氧化氮的转化率,只要改变条件使化学平衡向正反应方向移动即可,依据平衡移动原理分析选项;
(3)根据平衡常数表达式结合三行式来计算物质的平衡浓度;
(4)根据反应①②③得到亚硝酸钠、高锰酸钾、消耗Na2S2O3之间的量的关系式为:5NO2-~2MnO4-,10Na2S2O3~5I2~2MnO4-,据此回答计算.
解答 解:(1)已知:①CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3kJ•mol-1,②N2(g)+O2(g)═2NO(g)△H=+180kJ•mol-1
根据盖斯定律:①-2×②得CH4(g)+4NO(g)═CO2(g)+2N2(g)+2H2O(l),△H=-890.3kJ•mol-1-2×(+180kJ•mol-1)=-1250.3 kJ•mol-1;
故答案为:-1250.3 kJ•mol-1;
(2)该反应是反应前后气体体积减小的、放热的可逆反应,要使该反应向正反应方向移动,可改变反应物的浓度、体系的压强、温度等,
A、减小N02的浓度,平衡向逆反应方向移动,N02的转化率降低,故A错误;
B.降低温度,平衡向正反应方向移动,N02的转化率提高,故B正确;
C.增加N02的浓度,相当于体系压强增大,利于反应向正反应方向移动,N02的转化率提高,故C正确;
D.升高温度,平衡向逆反应方向移动,N02的转化率降低,故D错误;
故答案为:BC;
(3)根据题意知平衡时:c(N2O4)=0.0120mol/L,设c(NO2)=xmol/L; K=$\frac{0.012}{{x}^{2}}$=$\frac{40}{3}$,解得x=0.03mol/L,故答案为:平衡时:c(N2O4)=0.0120mol/L,设c(NO2)=xmol/L; K=$\frac{0.012}{{x}^{2}}$=$\frac{40}{3}$,解得x=0.03mol/L,答:平衡时NO2物质的量浓度是0.03mol/;
(4)6.00mL1.0mol•L-1的高锰酸钾标准溶液的物质的量是1.0mol/L×0.006L=0.006mol,设和碘离子反应消耗的高锰酸钾的物质的量位n,则:
10Na2S2O3~5I2~2MnO4-,
10 2
0.1mol/L×0.02L n
n=0.0004mol,和亚硝酸钠反应的高锰酸钾的量是0.006mol-0.0004mol=0.0056mol,根据关系式:5NO2-~2MnO4-,得到
5NO2-~2MnO4-,
5×69 2mol
0.0056mol
所以亚硝酸钠的质量:$\frac{0.0056mol×5×69}{2mol}$g=0.966g,所以亚硝酸钠的质量分数为:$\frac{0.966g}{1.0g}$×100%=96.6%,
答:亚硝酸钠的质量分数是96.6%.
点评 本题考查化学平衡计算、反应热计算、影响化学平衡因素分析判断、物质含量的测定等知识,注意滴定实验的计算是难点,掌握基础是解题关键,难度中等.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2A在水溶液中的电离方程式为H2A=2H++A2- | |
| B. | 该温度下,将0.01mol/L的H2A溶液稀释20倍后溶液的pH=3 | |
| C. | 体积相同,pH均为1的盐酸和H2A溶液分别与足量的Zn反应,产生H2较多的是H2A | |
| D. | 将0.1mol/L的H2A溶液与0.2mol/L的氨水等体积混合后,溶液中浓度最大的离子是NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
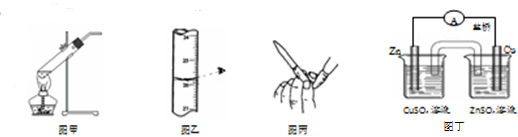
| A. | 用图甲所示装置加热分解NaHCO3固体 | |
| B. | 用图乙所示读取滴定管读数 | |
| C. | 用图丙所示排碱式滴定管尖嘴内的气泡 | |
| D. | 用图丁所示装置构成铜锌原电池 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
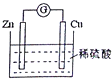
| A. | Zn片是正极 | |
| B. | 电池工作时,H+在铜片上得电子 | |
| C. | 电池工作时,电能转变为化学能,且锌片逐渐被消耗 | |
| D. | 电池工作时,电子从锌片通过硫酸溶液流向铜片 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用FeCl3溶液刻制铜材电路板 | |
| B. | 用乙醇作萃取剂从碘水中提取碘 | |
| C. | 在常温下用铝制容器贮运浓硫酸 | |
| D. | 向含硫高的煤中加入生石灰,可减少燃料对大气的污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:2:3 | B. | 23:24:37 | C. | 23:12:9 | D. | 36:69:92 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com