
实验室用废铁屑(其中还有少量铁锈、铜屑)制取少量纯净的绿矾(FeSO4?7H2O)。
(1)取稍过量的铁屑和硫酸加热、搅拌、充分反应,铁屑要稍过量的原因是
 ;
;
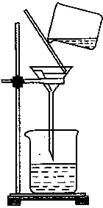
(2)过滤的目的是 右图过滤装置中的错误之处是 ;。
(3)将滤液转移到蒸发皿中,放在石棉网上加热、蒸发,浓缩至 ,再冷却至室温,不能把滤液加强热蒸干的原因是 ;
(4)用玻璃棒把固体移入一个新制的过滤器里,用少量蒸馏水均匀冲洗,然后用滤纸把晶体表面水分吸干即得纯净的绿矾晶体。用蒸馏水冲洗的目的是 。
 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:高中化学 来源: 题型:
 亚铁盐在空气中易被氧化,但形成复盐可稳定存在.硫酸亚铁铵[(NH4)2SO4?FeSO4?6H2O]为浅绿色晶体,商品名为摩尔盐,易溶于水,不溶于乙醇. 通常可用如下步骤在实验室中少量制备:
亚铁盐在空气中易被氧化,但形成复盐可稳定存在.硫酸亚铁铵[(NH4)2SO4?FeSO4?6H2O]为浅绿色晶体,商品名为摩尔盐,易溶于水,不溶于乙醇. 通常可用如下步骤在实验室中少量制备:查看答案和解析>>
科目:高中化学 来源:2012-2013学年广东省广州市毕业班综合测试(二)理综化学试卷(解析版) 题型:实验题
亚铁盐中,FeSO4•7H2O露置于空气中易被氧气氧化,而莫尔盐[(NH4)2SO4•FeSO4•6H2O]露置于空气中不易被氧气氧化,是一种重要的定量分析试剂。其制备原理是:FeSO4+(NH4)2SO4+6H2O =(NH4)2SO4•FeSO4•6H2O。
实验室用废铁屑制备莫尔盐的过程如下:

(1)步骤I除锈的操作是:将废铁屑放入烧杯, ,过滤,洗涤。
(2)步骤II铁屑的溶解在锥形瓶中进行,并水浴加热到60℃左右,需要的仪器是铁架台、石棉网、大烧杯、 。
(3)步骤III中加入的(NH4)2SO4与溶液中FeSO4的物质的量需满足的关系为:n[(NH4)2SO4]∶n[FeSO4]= 。
为了确定(NH4)2SO4的用量,下列方法简便可行的是 (填编号)。
A.称量废铁屑的质量,推算所需(NH4)2SO4的质量
B.称量无锈铁屑和步骤II之后剩余铁屑的质量,推算所需(NH4)2SO4的质量
C.测定FeSO4溶液的浓度和体积,推算所需(NH4)2SO4的质量
(4)所得晶体样品中可能混有的杂质是FeSO4·7H2O和(NH4)2SO4中的一种。某小组 设计了如下方案进行检验和测定,请在答题卡上完成表中内容。
|
序号 |
实验方案 |
实验现象和结论 |
|
步骤1 |
取少量样品 |
样品颜色可能有变化。 |
|
步骤2 |
步骤1后将样品转移到试管中,加入去氧蒸馏水,振荡溶解,调节至酸性,________ ___________ __ 。 |
若 ,说明样品中含有FeSO4·7H2O杂质。 |
|
步骤3 |
若步骤2证明样品不含FeSO4•7H2O杂质,再另取样品测定其中NH4+的质量分数w1与理论值w2比较。 |
若w1 w2,说明样品中含有(NH4)2SO4杂质。 |
(已知(NH4)2SO4•FeSO4•6H2O的式量为392,(NH4)2SO4的式量为132)
查看答案和解析>>
科目:高中化学 来源:辽宁省模拟题 题型:填空题
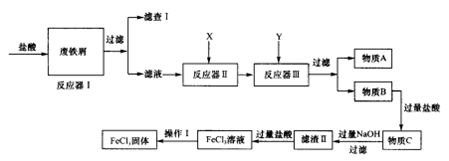
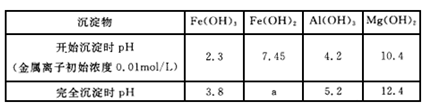
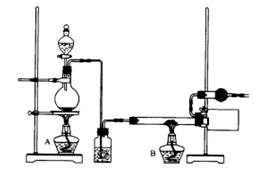
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com