
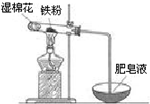
 ĢśŹĒČÕ³£Éś»īÖŠÓĆĶ¾×ī¹ć”¢ÓĆĮæ×ī“óµÄ½šŹō²ÄĮĻ£®
ĢśŹĒČÕ³£Éś»īÖŠÓĆĶ¾×ī¹ć”¢ÓĆĮæ×ī“óµÄ½šŹō²ÄĮĻ£®·ÖĪö £Ø1£©øł¾ŻĢśŗĶÅØĮņĖį¶Ū»ÆµÄŌĄķ½ā“š£»
£Ø2£©¢ŁŹŖĆŽ»Øŗ¬ÓŠĖ®ÕōĘų£¬¶Ō·“Ó¦Ą“ĖµĢį¹©ĮĖĖ®£¬ĢśŌŚøßĪĀĻĀÓėĖ®·“Ӧɜ³ÉĖÄŃõ»ÆČżĢśŗĶĒāĘų£¬¾Ż“Ė·ÖĪö½ā“š¼“æÉ£»
¢Ś²śĪļĖÄŃõ»ÆČżĢśÖŠÓŠ+2¼ŪµÄĢśŗĶ+3¼ŪµÄĢś£¬»¹ÓŠæÉÄÜÓŠ¹żĮæµÄĢś£»
£Ø3£©¢ŁĢśŹĒ½šŹō¾ßÓŠ»¹ŌŠŌ£¬ÅØĮņĖį¾ßÓŠŃõ»ÆŠŌ£¬Ģś±»Ńõ»Æ³É+3¼ŪĢś£¬ÅØĮņĖį±»»¹Ō³É+4¼ŪµÄĮņ£»
¢ŚĢ¼µ„ÖŹŗĶÅØĮņĖįŌŚ¼ÓČȵÄĢõ¼žĻĀÉś³É¶žŃõ»ÆĢ¼ŗĶ¶žŃõ»ÆĮņ£»
¢ŪÉś³ÉµÄSO2¾ßÓŠ»¹ŌŠŌ£¬ĶØČė×ćĮæäåĖ®ÖŠ£¬·¢ÉśSO2+Br2+2H2O=2HBr+H2SO4£¬ĄūÓĆĮņŌŖĖŲµÄŹŲŗć£¬½įŗĻ¹ŲĻµŹ½£ŗSO2”śBaSO4Ēó³öSO2µÄĢå»ż·ÖŹż£®
½ā“š £Ø1£©³£ĪĀĻĀ£¬ĢśŌŚÅØĮņĖįÖŠ·¢Éś¶Ū»ÆĻÖĻóŹ¹Ģś±ķĆęŠĪ³ÉŅ»²ćÖĀĆÜĪČ¶ØµÄŃõ»ÆĤ£¬¹ŹĢśÖĘĘ·ČŻĘ÷æÉŅŌŹ¢·ÅÅØĮņĖį£¬
¹Ź“š°øĪŖ£ŗÅØĮņĖįŹ¹Ģś±ķĆęŠĪ³ÉŅ»²ćÖĀĆÜĪČ¶ØµÄŃõ»ÆĤ£»
£Ø2£©¢ŁŅņĪŖŹĒĢśŗĶĖ®ÕōĘųµÄ·“Ó¦£¬ŹŌ¹ÜÄŚÓŠĢś·Ū£¬ĖłŅŌŹŖĆŽ»ØÖ÷ŅŖŹĒĢį¹©Ė®ÕōĘų£»ĢśŌŚøßĪĀĻĀÓėĖ®·“Ӧɜ³ÉĖÄŃõ»ÆČżĢśŗĶĒāĘų£¬·“Ó¦·½³ĢŹ½ĪŖ£ŗ3Fe+4H2O$\frac{\underline{\;øßĪĀ\;}}{\;}$Fe3O4+4H2£¬
¹Ź“š°øĪŖ£ŗĢį¹©Ė®ÕōĘų£»3Fe+4H2O$\frac{\underline{\;øßĪĀ\;}}{\;}$Fe3O4+4H2£»
¢ŚĢśŗĶĖ®ÕōĘų·“Ó¦£¬²śĪļĪŖĖÄŃõ»ÆČżĢśŗĶĒāĘų£¬¼ÓČė¹żĮæŃĪĖį£¬¹ĢĢåĶźČ«Čܽā£¬±Ų·¢Éś·“Ó¦£ŗFe3O4+8HCl=FeCl2+2FeCl3+4H2O£¬ĖłŅŌĖłµĆČÜŅŗÖŠ“ęŌŚµÄŃōĄė×ÓŹĒŅ»¶ØÓŠFe2+”¢H+£¬ĖÄŃõ»ÆČżĢśŗŚÉ«¹ĢĢåÖŠæÉÄÜŗ¬ÓŠ¹żĮæµÄĢś£¬æÉÄܽ«Čż¼ŪĢśĄė×ÓČ«²æ×Ŗ»Æ³É¶ž¼ŪĢśĄė×Ó£¬Fe+2Fe3+ØT3Fe2+£¬ĖłŅŌĖłµĆČÜŅŗÖŠ“ęŌŚµÄŃōĄė×ÓŹĒŅ»¶ØÓŠFe2+”¢H+£¬æÉÄÜÓŠFe3+£¬
¹Ź“š°øĪŖ£ŗb£»
£Ø3£©¢ŁĢśŗĶÅØĮņĖį·“Ó¦Ģś±»Ńõ»Æ³É+3¼ŪĢś£¬ÅØĮņĖį±»»¹Ō³É+4¼ŪµÄĮņ£¬Éś³ÉĮņĖįĢśŗĶ¶žŃõ»ÆĮņŗĶĖ®£¬
·“Ó¦·½³ĢŹ½ĪŖ£ŗ2Fe+6H2SO4£ØÅØ£©$\frac{\underline{\;\;”÷\;\;}}{\;}$Fe2£ØSO4£©3+3SO2”ü+6H2O
¹Ź“š°øĪŖ£ŗ2Fe+6H2SO4£ØÅØ£©$\frac{\underline{\;\;”÷\;\;}}{\;}$Fe2£ØSO4£©3+3SO2”ü+6H2O£»
¢ŚŌŚ·“Ó¦µÄ¹ż³ĢÖŠ£¬Ģ¼µ„ÖŹæÉŅŌŗĶÅØĮņĖį·“Ӧɜ³É¶žŃõ»ÆĢ¼”¢¶žŃõ»ÆĮņµČĘųĢ壬
¹Ź“š°øĪŖ£ŗC+2H2SO4£ØÅØ£©$\frac{\underline{\;\;”÷\;\;}}{\;}$CO2+2SO2+2H2O£»
¢ŪSO2¾ßÓŠ»¹ŌŠŌ£¬ĶØČė×ćĮæäåĖ®ÖŠ£¬·¢ÉśSO2+Br2+2H2O=2HBr+H2SO4£¬Ąė×Ó·½³ĢŹ½µÄŹéŠ“£¬½«²śĪļÖŠµÄĒāäåĖįŗĶĮņĖį²š³ÉĄė×Ó£¬ĖłŅŌĄė×Ó·½³ĢŹ½ĪŖ£ŗSO2+Br2+2H2OØT2Br-+SO42-+4H+£¬Éś³ÉµÄĮņĖįÓöµ½ĀČ»Æ±µ»į²śÉś°×É«³Įµķ£¬æÉŅŌĻČĻ“µÓČ»ŗóŌŁ¹żĀĖĄ“»ńµĆ“æ¾»µÄĮņĖį±µ³Įµķ£¬Ōņn£Ø»ģŗĻĘųĢ壩=$\frac{0.672L}{22.4L/mol}$=0.03mol£¬
SO2 ”«BaSO4
1mol 233g
n 4.66g
n=0.02mol£¬
Ōņ SO2µÄĢå»ż·ÖŹż£ŗ$\frac{0.02}{0.03}$”Į100%=$\frac{2}{3}$£¬
¹Ź“š°øĪŖ£ŗSO2+Br2+2H2OØT2Br-+SO42-+4H+£»$\frac{2}{3}$£®
µćĘĄ ±¾Ģāæ¼²éĢś¼°Ęä»ÆŗĻĪļµÄŠŌÖŹŹµŃ飬½įŗĻĻą¹ŲµÄ»Æѧ·“Ó¦ŌĄķŹĒ½ā“šµÄ¹Ų¼ü£¬±¾ĢāÄѶČÖŠµČ£®


 ѧĮ·æģ³µµĄæģĄÖ¼ŁĘŚŗ®¼Ł×÷ŅµĻµĮŠ“š°ø
ѧĮ·æģ³µµĄæģĄÖ¼ŁĘŚŗ®¼Ł×÷ŅµĻµĮŠ“š°ø ŠĀĖ¼Ī¬ŗ®¼Ł×÷ŅµĻµĮŠ“š°ø
ŠĀĖ¼Ī¬ŗ®¼Ł×÷ŅµĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ±ź×¼×“æöĻĀ£¬0.1 mol/L CH3COONaČÜŅŗÖŠ£¬CH3COO-øöŹżŠ”ÓŚ0.1NA | |
| B£® | K”¢Zn·Ö±šÓėĻ”ĮņĖį·“Ó¦ĖłµĆČÜŅŗ¾ł³ŹÖŠŠŌ | |
| C£® | Fe·Ö±šÓėĀČĘųŗĶĻ”ŃĪĖį·“Ó¦ĖłµĆĀČ»ÆĪļĻąĶ¬ | |
| D£® | C”¢P”¢S”¢ClµÄ×īøß¼ŪŃõ»ÆĪļ¶ŌÓ¦Ė®»ÆĪļµÄĖįŠŌÖš½„ŌöĒæ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢā
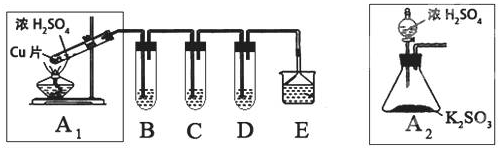
| ŹµŃé²Ł×÷ | Ō¤ĘŚĻÖĻóÓė½įĀŪ |
| ²½Öč1£ŗČ”ŹŹĮæ”°ĪüŹÕŅŗ”±ÓŚŠ”ÉÕ±ÖŠ£¬ÓĆ½ŗĶ·µĪ¹ÜČ”1mol/L BaCl2ČÜŅŗĻņŠ”ÉÕ±µĪ¼ÓÖ±ÖĮ¹żĮ森 | Čō³öĻÖ°×É«»ė×Ē£¬ŌņČÜŅŗÖŠ“ęŌŚSO32-»ņ SO42-£® |
| ²½Öč2£ŗ½«Š”ÉÕ±ÖŠµÄ×ĒŅŗ¹żĀĖ”¢Ļ“µÓ£¬ŌŁÓĆŹŹĮæĖ®°Ńø½ŌŚĀĖÖ½ÉĻµÄ¹ĢĢå³åČėĮķŅ»Š”ÉÕ±ÖŠ£»Ļņ³åĻĀµÄ¹ĢĢåµĪČė1µĪ£Ø»ņÉŁĮæ£©Ę·ŗģ£¬ŌŁµĪČė¹żĮæ2mol/LŃĪĖį£¬Õńµ“£® | |
| ²½Öč3£ŗÓĆŹŌ¹ÜČ”ŹŹĮæĀĖŅŗ£¬ĻņĘäÖŠ£Ø»ņŠ”ÉÕ±ÖŠ£©µĪČė¹żĮæµÄ1mol/LBa£ØOH£©2ČÜŅŗ[»ņµĪČė1µĪ£Ø»ņÉŁĮæ£©Ę·ŗģČÜŅŗ£¬ŌŁµĪČė2-3µĪ£Ø»ņ¹żĮ棩µÄ2mol/LŃĪĖį]£¬Õńµ“ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ÕäÖ锢Āźč§”¢ŗģ±¦ŹÆ”¢Ė®¾§µÄÖ÷ŅŖ³É·Ö¶¼ŹĒ¹čĖįŃĪ | |
| B£® | ¹¤ŅµÉĻŅ±Į¶½šŹōMg”¢Cu¶¼²ÉÓĆČČ»¹Ō·Ø | |
| C£® | ĀČĖ®”¢“×Ėį”¢Š”ĖÕ“ņ¶¼ŹĒµē½āÖŹ | |
| D£® | ĄūÓƶ”“ļ¶ūŠ§Ó¦æÉŅŌĒų±šNaClČÜŅŗŗĶFe£ØOH£©3½ŗĢå |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | °×É«³ĮµķŹĒCuI2£¬×ŲÉ«ČÜŅŗŗ¬ÓŠI2 | |
| B£® | µĪ¼ÓKIČÜŅŗŹ±£¬×ŖŅĘ1molµē×ÓŹ±Éś³É1mol°×É«³Įµķ | |
| C£® | ĶØČėSO2Ź±£¬SO2ÓėI2·“Ó¦£¬I2×÷»¹Ō¼Į | |
| D£® | ÉĻŹöŹµŃéĢõ¼žĻĀ£¬ĪļÖŹµÄŃõ»ÆŠŌ£ŗI2£¾Cu2+£¾SO2 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ĆŗµÄøÉĮóŹĒ»Æѧ±ä»Æ£¬¶ųĆŗµÄĘų»Æ”¢Ņŗ»ÆŹĒĪļĄķ±ä»Æ | |
| B£® | ŹÆÓĶĮŃ½āŹĒĪŖĮĖ»ńµĆøü¶ąĘūÓĶ£¬ŅŌĀś×ćŃøĖŁŌö³¤µÄĘū³µŠčŅŖ | |
| C£® | ĒāÄÜ”¢µēÄÜ”¢·ēÄܶ¼ŹĒĪŽ¶¾”¢ĪŽĪŪČ¾µÄĀĢÉ«ŠĀÄÜŌ“£¬æÉŅŌ°²Č«Ź¹ÓĆ | |
| D£® | ²£Į§ŹĒ½«ŹÆ»ŅŹÆ”¢“æ¼ī”¢ŹÆÓ¢ŌŚ²£Į§ČŪĀÆÖŠøßĪĀČŪČŚÖĘµĆµÄ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢā
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com