



科目:高中化学 来源:不详 题型:填空题
 成能把反应过程中所用的所有原材料尽可能多的转化到最终产物中)
成能把反应过程中所用的所有原材料尽可能多的转化到最终产物中) CH3OH(g) ΔH1
CH3OH(g) ΔH1 CH3OH(g) + H2O(g) ΔH2
CH3OH(g) + H2O(g) ΔH2 (g) ΔH =-1275.6 kJ·mol-1
(g) ΔH =-1275.6 kJ·mol-1
 mol甲醇。
mol甲醇。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.已知c(石墨,s)=c(金刚石,s);△H>0,则金刚石比石墨稳定 |
| B.已知I2(g)+H2(g)=2HI(g),△H1;I2(s)+H2(g)=2HI(g),△H2; 则△H1<△H2 |
| C.HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ba(OH)2反应的中和热△H=2×(-57.3)kJ/mol |
| D.已知H2(g)+F2(g)=2HF(g);△H=-270kJ/mol,则2L氟化氢气体分解成1L氢气和1L氟气吸收270kJ热量 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1:1 | B.1:2 | C.2:3 | D.3:2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.氢键是一种微弱的化学键 |
| B.离子键既可以存在于化合物又可以存在于单质中 |
| C.共价键既可以存在于化合物又可以存在于单质中 |
| D.范德瓦尔斯力是一种弱于化学键强于氢键的作用力 |
查看答案和解析>>
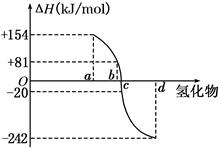
科目:高中化学 来源:不详 题型:单选题
| A.a<c<0 | B.b>d>0 | C.2a=b<0 | D.2c=d>0 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 。
。
 移向 (填“a”或“b”)电极,
移向 (填“a”或“b”)电极, 移向 (填“ A”或“B”)电极;
移向 (填“ A”或“B”)电极; (3)乙池中发生反应的离子方程式为 ;
(3)乙池中发生反应的离子方程式为 ;
 (标准状况下)。如何检验A处的产物 。
(标准状况下)。如何检验A处的产物 。 熔点、沸点数据如下:
熔点、沸点数据如下:| 物质 | Al |  | 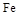 | 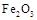 |
| 熔点/℃ | 660 | 2054 | 153 | 14 62 62 |
| 沸点/℃ | 2467 | 2980 | 2 750 750 | - |
 。
。 试剂中最适宜的试剂是
试剂中最适宜的试剂是 查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.该离子化合物中1mol阳离子共有15mol电子 |
| B.在此反应中O2是氧化剂,PtF6是还原剂 |
| C.每生成O2PtF61mol转移2mol电子 |
| D.该离子化合物中只含离子键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com