
|
为除去CO2中的SO2气体,可将气体通入 | |
| [ ] | |
A. |
饱和NaCl溶液 |
B. |
饱和NaOH溶液 |
C. |
饱和NaHCO3溶液 |
D. |
饱和NaHSO3溶液 |
科目:高中化学 来源: 题型:阅读理解
2- 4 |
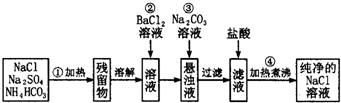
2- 4 |
2- 4 |
2- 4 |
2- 4 |
2- 4 |
2- 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
2- 4 |
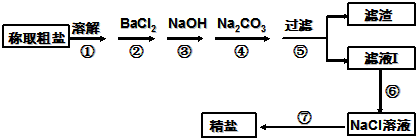
查看答案和解析>>
科目:高中化学 来源: 题型:

2- 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
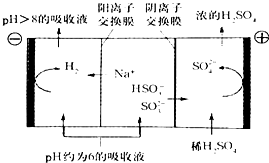 最近雾霾天气肆虐我国大部分地区.其中SO2是造成空气的污染的主要原因,利用钠碱循环法可除去SO2.
最近雾霾天气肆虐我国大部分地区.其中SO2是造成空气的污染的主要原因,利用钠碱循环法可除去SO2.| O | 2- 3 |
| O | - 3 |
| O | - 3 |
| O | 2- 3 |
N(SO
|
91:9 | 1:1 | 1:91 | ||||
| pH | 8.2 | 7.2 | 6.2 |
2- 3 |
- 3 |
- 3 |
2- 3 |
2- 3 |
2- 3 |
- 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
用一种试剂除去下列各物质中的杂质(括号内为杂质),并写出离子方程式。
(1)BaCl2(HCl)∶试剂__________,
离子方程式为:__________________________________。
(2)O2(CO2):试剂__________________,
离子方程式为:______________________________。
(3)SO![]() (CO
(CO![]() )∶试剂____________,
)∶试剂____________,
离子方程式为:________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com