
(14分)Ⅰ.M、A、B、C、D、E均为短周期主族元素,A的最外层电子数是M的4倍,A、B、C、D、E、F在周期表中位置如图所示。(请用化学用语作答)
A | B | C | D |
E | F |
(1)A在周期表中的位置 。
(2)D、E、F三种元素形成的简单离子半径由大到小的顺序为 。
(3)由M、B、C三种元素以原子个数比4:2:3形成化合物Q,Q中所含化学键类型有 。检验该化合物中阳离子的方法是 。(用离子方程式表示)。
(4)B与C可组成质量比为7:16的三原子分子,该分子释放在空气中其化学作用可能引发的后果有 。
①酸雨 ②温室效应 ③光化学烟雾 ④臭氧层破坏
Ⅱ.一定条件下,2X(g)+Y(g) 2Z(g)+W(s)。
2Z(g)+W(s)。
(5)若反应在恒容绝热(不与外界交换能量)条件下进行,按下表数据投料,反应达到平衡状态,测得体系压强升高。
物质 | X | Y | Z | W |
起始投料/ mol | 2 | 1 | 2 | 0 |
升高温度,该反应平衡常数将 _______(填“增大”“减小”或“不变”)。
(6)若反应在恒温、容积可变的密闭容器中进行,通过压缩容器体积改变压强,分别测得Y的平衡浓度如下表:
实验序号 | ① | ② | ③ |
压强p/Pa | 1×105 | 2×105 | 1×106 |
c(Y)/mol·L-1 | 0.08 | 0.12 | 0.68 |
当压强为1×106 Pa时,此反应的平衡常数表达式为 。
(1)第二周期ⅣA族(2分) (2)S2->Cl->F-(2分)
(3)离子键、(极性)共价键(配位键)(2分) NH4+ + OH- NH3↑ + H2O(2分)
NH3↑ + H2O(2分)
(4)①③④ (2分) (5)减小(2分) (6) K=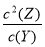 (2分)
(2分)
【解析】
试题分析:M、A、B、C、D、E均为短周期主族元素,根据A、B、C、D、E、F在周期表中位置可判断,A、B、C、D位于第二周期,E和F位于第三周期。A的最外层电子数是M的4倍,则A位于第ⅣA族,即A是碳元素,所以B、C、D、E、F分别是N、O、F、S、Cl。M的原子序数是1,是氢元素。
(1)氮元素在周期表中的位置为第二周期ⅣA族。
(2)离子的电子层数越多离子半径越大,在核外电子排布相同的条件下,离子半径随原子序数的增大而减小,则D、E、F三种元素形成的简单离子半径由大到小的顺序为S2->Cl->F-。
(3)由H、N、O三种元素以原子个数比4:2:3形成化合物Q是NH4NO3,其中铵根与硝酸根之间存在离子间,氮元素与氧元素以及氮元素与氢元素之间经还存在极性键。铵根离子能与强碱反应放出氨气,据此可以检验铵根离子,反应的离子方程式为NH4+ + OH- NH3↑ + H2O。
NH3↑ + H2O。
(4)N与O可组成质量比为7:16的三原子分子,其中N与O原子的个数之比是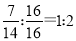 ,则该分子是NO2。NO2在空气中能形成酸雨和光化学烟雾,同时还能破坏臭氧层,当不会形成温室效应,CO2可以形成温室效应,答案选①③④。
,则该分子是NO2。NO2在空气中能形成酸雨和光化学烟雾,同时还能破坏臭氧层,当不会形成温室效应,CO2可以形成温室效应,答案选①③④。
(5)反应在恒容绝热(不与外界交换能量)条件下进行,反应达到平衡状态,测得体系压强升高。由于正反应是体积减小的,因此根据PV=nRT可知,温度升高,所以正反应是放热反应,则升高温度,平衡向逆反应方向进行,因此该反应平衡常数将减小。
(6)根据表中数据可知当压强由1×105Pa升高到2×105Pa时,Y的平衡浓度小于原来的2倍,这说明增大压强平衡向正反应方向进行。当压强由2×105Pa升高到1×106Pa时,Y的平衡浓度大于原来的5倍,这说明增大压强平衡向逆反应方向进行,因此X一定不是气态,所以当压强为1×106 Pa时,此反应的平衡常数表达式为K=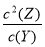 。
。
考点:考查元素周期表和元素周期律的应用以及外界条件对平衡状态的影响


科目:高中化学 来源:2014-2015学年湖南省郴州市高三第二次月考理综化学试卷(解析版) 题型:选择题
短周期元素X、Y、Z在元素周期表中的相对位置如图所示,其中Z的原子序数是X的2倍。下列说法正确的是:

A.三种元素中,元素Z的最高价氧化物对应水化物的酸性最强
B.单核阴离子半径的大小顺序为:r(Z)>r(Y)>r(X)
C.元素X和元素Z的氢化物中均只存在极性共价键
D.元素X和元素Z的最高正化合价相同
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河北省唐山市高三上学期期末理综化学试卷(解析版) 题型:选择题
用下列实验装置和方法进行相应实验,能达到实验目的的是

A.用甲装置制干燥的氨气
B.用乙装置收集并测量Cu与浓硝酸反应产生的气体及体积
C.用丙装置除去CO2中含有的少量HC1
D.用丁装置吸收NH3,并防止倒吸
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省泉州市高三上学期期末化学试卷(解析版) 题型:选择题
下列方程式错误的是
A.0.1mol·L-1CH3 COOH溶液的pH为3:CH3 COOH H++CH3 COO—
H++CH3 COO—
B.A1Cl3溶液中加入过量稀氨水:A13++3NH3·H2 O=A1(OH)3↓+3 NH4+
C.C12与过量的铁反应:3C12+2Fe 2FeCl3
2FeCl3
D.NaHCO3溶液中加入稀盐酸:CO32一+2H+=CO2↑+H2 O
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省泉州市高三上学期期末化学试卷(解析版) 题型:选择题
下列说法正确的是
A.14C、14N互为同位素
B.H2 O、CH3COOH、NH4 HCO3都属于电解质
C.铝、铁、铜对应的氧化物均为碱性氧化物
D.金属阳离子被还原时一定得到金属单质
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省等三校高三上学期联考化学试卷(解析版) 题型:选择题
已知HCN、CN—在溶液中存在下列平衡及其对应的平衡常数:
①HCN H++CN— △H1>0 K1
H++CN— △H1>0 K1
②CN— +H2O HCN+OH- △H 2>0 K2
HCN+OH- △H 2>0 K2
常温下(K1=6.2×10-10),将等体积、等物质的量浓度的HCN和NaCN溶液混合,下列叙述正确的是
A.混合溶液的pH<7
B.对混合溶液进行微热,K1 增大、K2 减小
C.K2≈ 1.6×10-5
D.c(Na+) = c(HCN) + c(CN‑)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省等三校高三上学期联考化学试卷(解析版) 题型:选择题
X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示。若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是
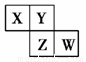
A.四种元素的单质中,Z的熔沸点最高
B.最高价氧化物对应水化物的酸性W比Z弱
C.Y的气态氢化物的稳定性较Z的弱
D.原子半径:W>Z>Y>X
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省宁德市高三上学期期末化学试卷(解析版) 题型:选择题
常温下,向饱和氯水中逐滴滴入0.1mol·L-1的氢氧化钠溶液,pH变化如下图所示,下列有关叙述正确的是
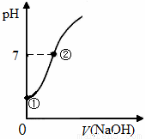
A.①点所示溶液中只存在HClO的电离平衡
B.②点所示溶液中:c(Na+)=c(Cl-) + c(ClO-)
C.I-能在②点所示溶液中存在
D.①到②水的电离程度逐渐减小
查看答案和解析>>
科目:高中化学 来源:2014-2015湖北省咸宁市高二上学期期末考试化学(B)试卷(解析版) 题型:选择题
H2S的水溶液中存在平衡:H2S  HS- + H+ 和HS-
HS- + H+ 和HS- S2-+H+,当增大溶液的pH时, c(S2-)怎样变化
S2-+H+,当增大溶液的pH时, c(S2-)怎样变化
A增大 B、减小 C、不变 D、可能增大也可能减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com