
Ⅰ.下列实验操作中正确的是
| A.分液时,分液漏斗下层液体从下端放出,上层液体从上口倒出 |
| B.蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 |
| C.蒸发结晶时应将溶液直接蒸干 |
| D.称量非腐蚀性药品应放在托盘天平左盘的称量纸上,砝码放在托盘天平右盘的称量纸上 |
| 实验步骤 | 现象 | 结论 |
| ①分别取等体积2mol/L的硫酸于试管中 ② | Mg产生气泡速率快于Fe,Cu无明显变化 | 金属性质越活泼,反应速率越快 |
(11分)Ⅰ.(3分,选对1个得1分,见错不得分,全选不得分)ABD
Ⅱ.(8分,每空2分)(1)分别投入形状、大小相同的Cu、Fe、Mg
(2)探究金属(反应物)本身的性质与反应速率的关系;温度相同
(3)测定同一金属与浓度不同但体积相同的硫酸产生一定体积的气体所需要的时间于(或在一定时间内产生气体的体积) (4)Mg(或Fe)、0.2mol/L硫酸和2mol/L硫酸
解析试题分析:Ⅰ.分液时,分液漏斗下层液体从下端放出,上层液体从上口倒出,A选项正确;蒸馏时,温度计测量的是气体温度,所以应使温度计水银球靠近蒸馏烧瓶支管口处,选项B正确;蒸发结晶时当出现大量晶体时即可停止加热,利用余热蒸干,选项C不正确;称量非腐蚀性药品应放在托盘天平左盘的称量纸上,砝码放在托盘天平右盘的称量纸上,选项D正确,答案选ABD。
Ⅱ.(1)根据甲同学的实验过程可知,该实验是通过观察不同的金属与相同的稀硫酸反应的反应速率来探究探究金属(反应物)本身的性质与反应速率的关系,所以需选用的实验药品为相同的浓度的硫酸,不同的金属,因此甲同学表中实验步骤②为分别投入形状、大小相同的Cu、Fe、Mg。
(2)根据以上分析可知,甲同学的实验目的是探究探究金属(反应物)本身的性质与反应速率的关系;为保证实验的准确性,还要保证实验时溶液的温度是相同的。
反应速率的表示方法为单位时间内反应物浓度的减少,或生成物浓度的增加.探究不同浓度的硫酸对反应速率的影响,所以可以测生成物气体的体积或生成气体所需的时间,故答案为:测定一定时间产生的体积(或者测定一定体积的气体所需的时间);
(3)该装置左边为分夜漏斗,锥形瓶,分液漏斗为加液体,锥形瓶为反应容器,右边为量气装置,且该装置不需加热,该实验的目的为探究不同浓度的稀硫酸与相同金属反应的反应速率,进行的是定量实验,所以乙同学在实验中应该测定的数据是测定同一金属与浓度不同但体积相同的硫酸产生一定体积的气体所需要的时间(或在一定时间内产生气体的体积)。
(4)根据以上分析可知,乙同学完成实验应选用的实验药品是Mg(或Fe)、0.2mol/L硫酸和2mol/L硫酸。
考点:考查化学实验基本操作、外界条件对反应速率影响的实验探究
点评:该题是高考中的常见题型,属于中等难度的试题。侧重对学生实验能力的考查,有利于培养学生规范严谨的实验设计能力,明确实验原理是答题的关键。该类试题主要是以常见仪器的选用、实验基本操作为中心,通过是什么、为什么和怎样做重点考查实验基本操作的规范性和准确性及灵活运用知识解决实际问题的能力。


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:实验题
K3[Fe(C2O4)3]·3H2O [三草酸合铁(Ⅲ)酸钾晶体]易溶于水,难溶于乙醇,可作为有机反应的催化剂。实验室可用铁屑为原料制备,相关反应过程如下,请回下列问题: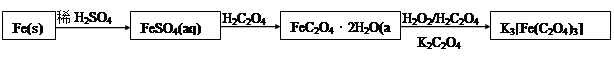
(1)铁屑中常含硫元素,因而在制备FeSO4时会产生有毒的H2S气体,该气体可用氢氧化钠溶液吸收。下列吸收装置正确的是 。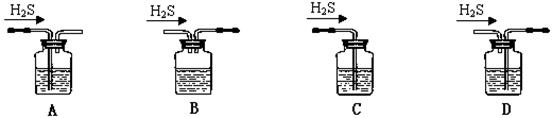
(2)在得到的FeSO4溶液中需加入少量的H2SO4酸化,目的是 ,得到K3[Fe(C2O4)3]溶液后,加入乙醇的目的是 。
(3)晶体中所含结晶水可通过重量分析法测定,主要步骤有:①称量,②置于烘箱中脱结晶水,③冷却,④称量,⑤重复②~④至恒重,⑥计算。
步骤③需要在干燥器中进行的原因是 ;
步骤⑤的目的是 。
(4)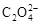 可被酸性KMnO4溶液氧化放出CO2气体,所以实验产物中K3[Fe(C2O4)3]·3H2O含量测定可用KMnO4标准溶液滴定。
可被酸性KMnO4溶液氧化放出CO2气体,所以实验产物中K3[Fe(C2O4)3]·3H2O含量测定可用KMnO4标准溶液滴定。
①写出滴定过程中发生反应的离子方程式 ;
②下列滴定操作中使滴定结果偏高的是 ;
| A.滴定管用蒸馏水洗涤后,立即装入标准液 |
| B.锥形瓶在装待测液前未用待测液润洗 |
| C.滴定前滴定管尖嘴处有气泡,滴定后气泡消失 |
| D.读取标准液体积时,滴定前仰视读数,滴定后俯视读数 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
资料显示:镁与饱和碳酸氢钠溶液反应产生大量气体和白色不溶物。某同学设计了如下实验方案并验证产物、探究反应原理。
(1)提出假设
实验I:用砂纸擦去镁条表面氧化膜,将其放入盛有适量滴有酚酞的饱和碳酸氢钠溶液的试管中,迅速反应,产生大量气泡和白色不溶物,溶液由浅红变红。
该同学对反应中产生的白色不溶物做出如下猜测:
猜测1:白色不溶物可能为 。
猜测2:白色不溶物可能为MgCO3。
猜测3:白色不溶物可能是碱式碳酸镁[xMgCO3·yMg(OH)2]。
(2)设计定性实验确定产物并验证猜测:
| 实验序号 | 实验 | 实验现象 | 结论 |
| 实验Ⅱ | 将实验I中收集到的气体点燃 | 能安静燃烧、产生淡蓝色火焰 | 气体成分为 _? _ |
| 实验Ⅲ | 取实验I中的白色不溶物,洗涤, 加入足量? | ? | 白色不溶物可能含有MgCO3 |
| 实验Ⅳ | 取实验I中的澄清液,向其中加入少量CaCl2稀溶液 | 产生白色沉淀 | 溶液中存在 ④ 离子 |
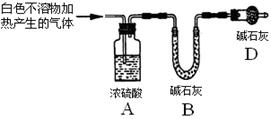
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
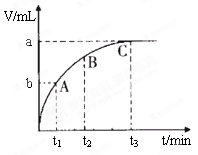
为了研究外界条件对过氧化氢分解速率的影响,某同学做了以下实验,请回答下列问题。
| 编号 | 操作 | 实验现象 |
| ① | 分别在试管A、B中加入5 mL 5% H2O2溶液,各滴入2滴1mol/L FeCl3溶液。待试管中均有适量气泡出现时,将试管A放入盛有5℃左右冷水的烧杯中浸泡;将试管B放入盛有40℃左右热水的烧杯中浸泡。 | 试管A中不再产生气泡; 试管B中产生的气泡量增大。 |
| ② | 另取两支试管分别加入5 mL 5% H2O2溶液和5 mL 10% H2O2溶液 | 试管A、B中均未明显见到有气泡产生。 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
在高温时硫铁矿(主要成分FeS2)和氧气反应生成三氧化二铁和二氧化硫(假设硫铁矿中的杂质不参与化学反应)。某化学研究学习小组对硫铁矿样品进行如下实验探究:
【实验一】测定硫元素的含量
I.实验装置如下图所示(夹持和加热装置已省略)。A中的试剂是双氧水,将m·g该硫铁矿样品放人硬质玻璃管D中。从A向B中逐滴滴加液体,使气体发生装置不断地缓缓产生气体,高温灼烧硬质玻璃管D中的硫铁矿样品至反应完全。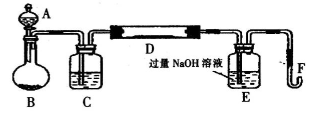
II.反应结束后,将E瓶中的溶液进行如下处理: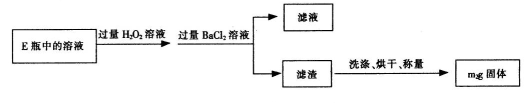
【实验二】测定铁元素的含量
III.测定铁元素含量的实验步骤如下:
①用足量稀硫酸溶解已冷却的硬质玻璃管D中的固体,过滤,得到滤液A;
②在滤液A中加入过量的还原剂使溶液中的Fe3+完全转化为Fe2+,过滤,得到滤液B;
③将滤液B稀释为250 mL;
④取稀释液25.00 mL,用浓度为c mol/L的酸性KMnO4溶液滴定,三次滴定实验所需KMnO4溶液体
积的平均值为V mL。
请根据以上实验,回答下列问题:
(1)I中装置C中盛装的试剂是_ ;E瓶的作用是_ 。
(2)11中加入过量H2O2溶液发生反应的离子方程式为____。
(3)111的步骤③中,将滤液B稀释为250 mL需要用到的玻璃仪器除烧杯、玻璃棒、胶头滴管外,
还必须要用到的是_ ;④中盛装KMnO3溶液的仪器是_ 。
(4)假设在整个实验过程中硫元素和铁元素都没有损失,则该硫铁矿样品中硫元素的质量分数为_ 。(用含m1和m2的代数式表示);铁元素的质量分数为____。(用含m1、c、v的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列关于教材中的各项说法错误的一项是( )
| A.在化学反应中,反应物转化为生成物的同时,必然发生能量的变化 |
| B.氮肥包括铵态氮肥、硝态氮肥和尿素 |
| C.在书写热化学方程式时应标明反应物及生成物的状态,无需标明反应温度和压强 |
| D.医疗上用的石膏绷带是利用熟石膏与水混合成糊状后很快凝固的性质 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
化学与生活、社会密切相关。下列说法不正确的是( )
| A.利用太阳能等清洁能源代替化石燃料,有利于节约资源、保护环境 |
| B.凡含有食品添加剂的食物对人体健康均有害,不可食用 |
| C.为防止电池中的重金属等污染土壤和水体,应积极开发废电池的综合利用技术 |
| D.提倡人们购物时不用塑料袋,是为了防止白色污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
化学与人类生活密切相关,下列与化学有关的说法正确的是
| A.化学药品着火,都要立即用水或泡沫灭火器灭火 |
| B.开发和推广新能源是实现低碳生活的途径之一 |
| C.食品包装袋中常放入小袋的生石灰,目的是防止食品氧化变质 |
| D.纤维素在人体内可水解为葡萄糖,故可作人类的营养物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
调味剂是日常生活中离不开的食品添加剂,有关其说法正确的是 ( )。
| A.食盐是咸味剂,工业上常用电解饱和食盐水制备氯气和钠 |
| B.食醋的主要成分是醋酸,将一定量的醋酸溶液稀释,溶液中各离子的浓度都减小 |
| C.味精的主要成分是谷氨酸钠,向其中加入盐酸可得谷氨酸,谷氨酸具有两性 |
| D.木糖醇(C5H12O5)是一种甜味剂,它属于多羟基化合物,与葡萄糖互为同分异构体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com