
【题目】A原子的L层比B原子L层少3个电子,B原子核外电子总数比A原子多5个,由此AB可形成( )
A.离子化合物B2A3B.离子化合物B3A2C.共价化合物B3A2D.共价化合物B2A3
科目:高中化学 来源: 题型:
【题目】下列关于SO2性质的说法中,不正确的是
A. 能使品红溶液褪色 B. 能与水反应生成硫酸
C. 能与NaOH溶液反应 D. 能使酸性KMnO4溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的原电池装置,X、Y为两电极,电解质溶液为稀硫酸,外电路中的电子流向如图所示,对此装置的下列说法正确的是( )
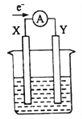
A. 外电路的电流方向为:X→外电路→Y
B. 若两电极分别为Zn和石墨棒,则X为石墨棒,Y为Zn
C. SO42-移向X电极,Y电极上有氢气产生
D. X极上发生的是还原反应,Y极上发生的是氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.羰基硫(COS)可作为熏蒸剂,分子结构与CO2相似。回答下列问题:
(1)碳原子的核外电子排布式为____________;组成羰基硫的元素中,半径最大的原子其核外有_____种不同能量的电子。
(2)羰基硫为___(填“极性”或“非极性”)分子,羰基硫的电子式为_____________。
(3)解释稳定性CO2大于CS2的原因________________________________________。
II.密闭容器中,发生反应:CO(g)+H2S(g)![]() COS(g)+H2(g)
COS(g)+H2(g)
(4)已知逆反应速率随时间变化如图所示,则t0时改变的条件可能是_____________或________________。
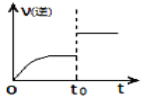
(5)该反应达到平衡后,其他条件不变,升高温度,H2S浓度增加,表明该反应是___(填“放”或“吸”)热反应,平衡常数K将____(填“增大”、“减小”或“不变”);若在反应体系中通入一定量SO2(g),判断平衡移动的方向并解释原因。 ________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I. 某实验小组对H2O2的分解做了如下探究。下表是研究影响H2O2分解速率的因素时记录的一组数据,将质量相同但状态不同的MnO2分别加入盛有15 mL5%的H2O2溶液的大试管中,并用带火星的木条测试,结果如下:
MnO2 | 触摸试管情况 | 观察结果 | 反应完成所需的时间 |
粉末状 | 很烫 | 剧烈反应,带火星的木条复燃 | 3.5 min |
块状 | 微热 | 反应较慢,火星红亮,但木条未复燃 | 30 min |
(1)该反应是_________反应(填“放热”或“吸热”)。
(2)实验结果表明,催化剂的催化效果与_____________有关。
Ⅱ.某可逆反应在体积为5 L的密闭容器中进行,0~3分钟内各物质的物质的量变化情况如图所示(A、B、C均为气体)。
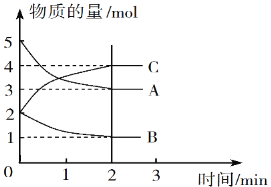
(3)该反应的化学方程式为_____________。
(4)反应开始至2分钟时,B的平均反应速率为__________。
(5)能说明该反应已达到平衡状态的是_________(填字母)。
A.v(A)= 2v(B) B.容器内压强保持不变
C.v逆(A)= v正(C) D.容器内混合气体的密度保持不变
Ⅲ.已知:断开1 mol共价键吸收的能量或形成1 mol共价键释放的能量数据如下表:
共价键 | H—H | N—H | N≡N |
能量变化/kJ·mol1 | 436 | 390.8 | 946 |
(6)已知合成氨反应:N2(g)+3H2(g)![]() 2NH3(g),则N2(g)与H2(g)反应有2 mol NH3(g)生成时,能量的变化情况是_________(填“吸收”或“放出”以及具体数值)kJ。
2NH3(g),则N2(g)与H2(g)反应有2 mol NH3(g)生成时,能量的变化情况是_________(填“吸收”或“放出”以及具体数值)kJ。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物A(C9H18O2)在稀硫酸溶液中水解为相对分子质量相等的B、C,其中B分子中含有 3个甲基,则A、B、C中能与氢氧化钠溶液反应的物质最多有(不考虑立体异构)
A. 10种 B. 8种 C. 6种 D. 4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是食用碘盐包装上的部分说明,下列说法正确的是( )
配料:精盐、碘酸钾、抗结剂
碘含量:35±15 mg/kg
储存方法:密封、避光、防潮
食用方法:烹饪时,待食品熟后加入碘盐
A.高温会导致碘的损失
B.碘酸钾可氧化氯化钠
C.可用淀粉检验碘盐中的碘酸钾
D.该碘盐中碘酸钾含量为20~50 mg/kg
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组欲测定某已部分变质的小苏打样品中Na2CO3的质量分数,设计如下实验方案。
【方案一】称取一定质量样品,置于坩埚中加热至恒重后,冷却,称量剩余固体质量,计算。
(1)坩埚中发生反应的化学方程式为_______________。
(2)实验中,需加热至恒重的目的是_______________。
【方案二】称取一定质量样品,置于小烧杯中,加适量水溶解;向小烧杯中加入足量Ba(OH)2溶液,过滤,洗涤、干燥沉淀,称量固体质量,计算。(已知:Ba2++OH-+HCO3-==BaCO3↓+H2O)
(1)过滤操作中,除了烧杯、漏斗外,还要用到的玻璃仪器为_______________。
(3)实验中判断沉淀是否完全的方法是_______________。
【方案三】按如下图所示装置进行实验:
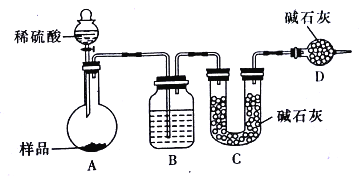
(1)D装置的作用是_______________。分液漏斗中_________(填“能”或“不能”)用盐酸代替稀硫酸进行实验。
(2)实验前称取17.90g样品,实验后测得C装置增重8.80g,则样品中Na2CO3的质量分数为________________(保留三位有效数字)
(3)根据此实验测得的数据,测定结果有误差,因为实验装置还存的在一个明显缺陷是________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com