
2012��2��27���������ƽ��롰200��������ʱ����������β���ѳ�Ϊ��Ҫ�Ŀ�����Ⱦ�
��1��������ȼ������ʱ����Ӧ��N2(g)+O2(g) 2NO(g)���ǵ�������β���к���NO��ԭ��֮һ��T��ʱ����2L�ܱ������г���4mol N2��6molO2��5min���ƽ��ʱNO���ʵ���Ϊ4mol���÷�Ӧ������v(N 2)Ϊ ������������µ�ƽ�ⳣ����д��������̣���
2NO(g)���ǵ�������β���к���NO��ԭ��֮һ��T��ʱ����2L�ܱ������г���4mol N2��6molO2��5min���ƽ��ʱNO���ʵ���Ϊ4mol���÷�Ӧ������v(N 2)Ϊ ������������µ�ƽ�ⳣ����д��������̣���
��2�����º��ݣ���˵����Ӧ 2NO(g)  N2(g)+O2(g) �ﵽƽ����� ������ţ���
N2(g)+O2(g) �ﵽƽ����� ������ţ���
| A��NO��N2��O2��Ũ��֮��Ϊ2��1��1 |
| B��N2��Ũ�Ȳ��ٷ����仯 |
| C����λʱ��������2 mol NO��ͬʱ����1 mol N2 |
| D�������������ܶȲ��ٷ����仯 |
 2CO2(g)+ N2(g) ��NO��Ũ�����¶�(T)�����������(S)��ʱ��(t)�ı仯���ߣ��ݴ��жϸ÷�Ӧ�ġ�H 0 (�����������������ȷ����)���������ı����S1��S2 ������ͼ�л���NO��Ũ����T1��S2�����´ﵽƽ������еı仯���ߣ���ע��������
2CO2(g)+ N2(g) ��NO��Ũ�����¶�(T)�����������(S)��ʱ��(t)�ı仯���ߣ��ݴ��жϸ÷�Ӧ�ġ�H 0 (�����������������ȷ����)���������ı����S1��S2 ������ͼ�л���NO��Ũ����T1��S2�����´ﵽƽ������еı仯���ߣ���ע��������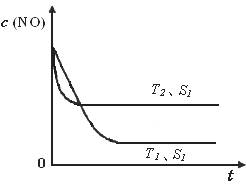
��1��0.2mol/(L��min)
N2(g)+O2(g) 2NO(g)
2NO(g)
��ʼŨ��(mol��L-1) 2.0 3.0 0
ת��Ũ��(mol��L-1) 1.0 1.0 2.0
ƽ��Ũ��(mol��L-1) 1.0 2.0 2.0
ƽ�ⳣ��K=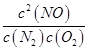 =
=
��2��BC
��3����2H2(g)+2NO(g)=N2(g)+2H2O(l) ��H=-752.1kJ/mol �ڣ�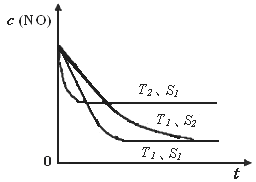
���������������1�����ݶ���ʽ��ֻ����ֱ�Ӽ���v(NO)=4mol��2L��5min=0.4mol/(L��min)���ٸ���ϵ���ȣ���Ӽ���v(N2)= v(NO)/2=0.2mol/(L��min)������ʼ���仯��ƽ��Ũ�ȹ�ϵ��֪��
N2(g)+O2(g) 2NO(g)
2NO(g)
��ʼŨ��/mol��L��1 2 3 0
�仯Ũ��/mol��L��1 1 1 2
ƽ��Ũ��/mol��L��1 1 2 2
K=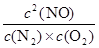 =
=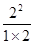 =2
=2
��2��A���˵���ﵽƽ�⣬��ΪNO��N2��O2�ı仯Ũ��֮��Ϊ2��1��1����ƽ��Ũ��֮�Ȳ�һ������ϵ��֮�ȣ�B����˵���ﵽƽ�⣬N2��Ũ�Ȳ��ٷ����仯��˵��N2���������ʵ����������ʣ����淴Ӧ���ʵ�������Ӧ���ʣ�C����˵���ﵽƽ�⣬��Ϊv(NO)����/v(N2)����=2/1�����v(NO)����/v(N2)����=2/1����v(N2)����= v(N2)������������Ӧ���ʵ����淴Ӧ���ʣ�D���˵���ﵽƽ�⣬����ֶ������壬���������������غ㣬�����ݻ����䣬�����Ƿ�ﵽƽ�⣬���������ܶ�һ�����䣻��3���ٵ�2���Ȼ�ѧ����ʽ��2����1���Ȼ�ѧ����ʽ����ԼȥO2(g)����2H2(g)+2NO(g)=2H2O(l)+N2(g) ��H="[(��285.8)" ��2��(+180.5)]kJ/mol=��752.1kJ/mol���������¶�������Ӧ���ʣ����̴ﵽƽ���ʱ�䣬�ɴ��ƶ�ͼ���¶�T1<T2����ͼ��T1��T2ʱc(NO)������������ƽ�������ȷ����ƶ���c(NO)����˵��ƽ�����淴Ӧ�����ƶ������淴Ӧ�����ȷ�Ӧ����������Ӧ�Ƿ��ȷ�Ӧ������Ӧ�ġ�H <0���ۻ�ͼҪ�㣺a�������T1��S1ʱ��ͬ��b��ƽ���� T1��S1ʱ������ΪT1��S1��T1��S2���Ǽ�С�������������Ӧ���ʼ�С���ﵽƽ���ʱ������ c��ƽ��ʱc(NO)��T1��S1ʱ��ͬ����Ϊ��������ʹƽ���ƶ���
���㣺���йػ�ѧ��Ӧ���ʡ���ѧƽ�⡢�Ȼ�ѧ����ʽ�Ļ�ѧ��Ӧԭ���⣬����ƽ����Ӧ���ʵ�ֱ�Ӻͼ�Ӽ��㷽������ѧƽ�ⳣ���ļ�����̡���ѧƽ��״̬�ı�־����˹���ɵ�Ӧ�á�����Ũ��-ʱ��ͼ���ƶ��ʱ�������������ı�һ������ʱ��Ũ��-ʱ��ͼ��ȳ���������ʽ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ʴ���
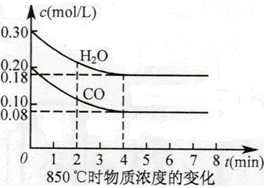
��֪��CO(g)+H2O(g)  CO2(g)+H2(g) ��H=Q����ƽ�ⳣ�����¶ȱ仯���±���ʾ��
CO2(g)+H2(g) ��H=Q����ƽ�ⳣ�����¶ȱ仯���±���ʾ��
| �¶�/�� | 400 | 500 | 850 |
| ƽ�ⳣ�� | 9.94 | 9 | 1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
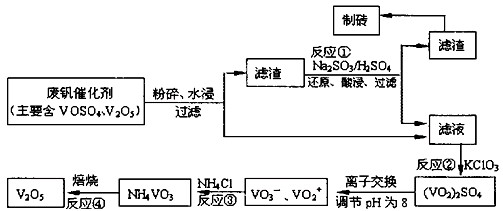
Ϊ�������÷Ϸ�����������V2O5��VOSO4�������Բ�������������Ա����������һ�����ӽ��������շ����¹��ա���֪��V���γ�VO2+��VO2+��VO3-�ȶ������ӣ����ֺ���������ˮ�е��ܽ������±���ʾ��
| ���� | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
| �ܽ��� | ���� | ���� | ���� | ���� |
 2SO3(g) ��H��0�����ݻ�Ϊ2.0 L���ܱ������г���2 mol SO2��1 mol O2��һ�������´ﵽƽ�⣬SO3���������Ϊ
2SO3(g) ��H��0�����ݻ�Ϊ2.0 L���ܱ������г���2 mol SO2��1 mol O2��һ�������´ﵽƽ�⣬SO3���������Ϊ ��
�� 2SO3(g) ��ƽ�ⳣ��Ϊ_____��
2SO3(g) ��ƽ�ⳣ��Ϊ_____��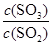 �������_____��
�������_____���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
��1�������������У�SO2����������SO3�Ƿ�Ӧ�Ĺؼ����䷴Ӧ�Ļ�ѧ����ʽΪ��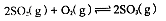 ����Ӧ�����ϵSO3�İٷֺ������¶ȵĹ�ϵ��ͼ��ʾ���������κ�һ�㶼��ʾƽ��״̬��������ͼʾ�ش��������⣺
����Ӧ�����ϵSO3�İٷֺ������¶ȵĹ�ϵ��ͼ��ʾ���������κ�һ�㶼��ʾƽ��״̬��������ͼʾ�ش��������⣺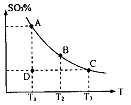
�ٷ�Ӧ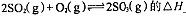 0���>����<���������ں��º��������£�������Ӧ�ﵽƽ�⣬�ٸ���ƽ����ϵ��ͨ��SO3���壬�����ڵ�ѹǿ �����������С�����䡱����ƽ�� �ƶ����������Ӧ���Ρ������淴Ӧ�����������ں��º�ѹ�����£�������Ӧ�ﵽƽ�⣬�ٸ���ƽ����ϵ��ͨ�˴�����������ϵ���´ﵽƽ�⣬��ƽ����ԭƽ����Ƚϣ�SO2�����ʵ��� __�����������С�����䡱����O2�����ʵ���Ũ�� �����������С�����䡱����
0���>����<���������ں��º��������£�������Ӧ�ﵽƽ�⣬�ٸ���ƽ����ϵ��ͨ��SO3���壬�����ڵ�ѹǿ �����������С�����䡱����ƽ�� �ƶ����������Ӧ���Ρ������淴Ӧ�����������ں��º�ѹ�����£�������Ӧ�ﵽƽ�⣬�ٸ���ƽ����ϵ��ͨ�˴�����������ϵ���´ﵽƽ�⣬��ƽ����ԭƽ����Ƚϣ�SO2�����ʵ��� __�����������С�����䡱����O2�����ʵ���Ũ�� �����������С�����䡱����
�����¶�ΪT1�� T2����Ӧ��ƽ�ⳣ���ֱ�ΪK1��K2 ��K1 K2���>������<����=��������Ӧ���е�D��״̬ʱ��V�� V�����>������<����=����
����һ���̶��ݻ�Ϊ5L���ܱ������г���0��20 mol SO2��0.10 mol O2����500�濪ʼ��Ӧ������Ӵﵽƽ�⣬��������ں�SO3 0��18 mol����v(O2)= mol��L-1��min-1��������ͨ��0��20 mol SO2��0.10 mol O2��ƽ�ⷢ�����ƶ����ٴδﵽƽ��� mol<n��SO3��< mol��
��2����֪������ɫ��Һ��a��NaHCO3��Һ��b��AlCl3��Һ��c��NaAlO2��Һ������������Ӧ��������Al��OH��3��������ش��������⣺
��������Һǡ����ȫ��Ӧ��������Һ��c(OH����=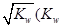 ��ˮ�����ӻ���������������Һ��Ϊ ������ĸ����
��ˮ�����ӻ���������������Һ��Ϊ ������ĸ����
�������ֳ�NaHCO3�ڷ�Ӧ�У�HCO��3��ˮ��̶�С�ڵ���̶ȵ����ڷ���ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
������ЧӦ����ȫ���ע�Ļ�������֮һ��CO2��Ŀǰ�����к�����ߵ�һ���������塣��ˣ����ƺ�����CO2�ǽ������ЧӦ����Ч;����
��1������ͬ����CO(g)��H2O(g)�ֱ�ͨ�뵽���Ϊ2L�ĺ����ܱ������У����з�ӦCO(g)+H2O(g) CO2(g)+H2(g)���õ������������ݣ�
CO2(g)+H2(g)���õ������������ݣ�
| ʵ���� | �¶�/�� | ��ʼ��/mol | ƽ����/mol | �ﵽƽ������ʱ��/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
 ��4��Ѱ������Դ�ǽ������ЧӦ��һ����Ҫ˼·�����������LiFePO4��һ��������������ӵ�أ��ܷ�ӦΪ��FePO4+Li LiFePO4������еĹ������ʿɴ���Li+����õ�طŵ�ʱ������������Ӧʽ�ֱ�Ϊ�� �� �����øõ�ص������ˮ�����ص缫��Ϊ���Ե缫������������������3360mL���壨��״��������ʱ���õ������﮵�����Ϊ ��(Li�����ԭ������ԼΪ7.0)
��4��Ѱ������Դ�ǽ������ЧӦ��һ����Ҫ˼·�����������LiFePO4��һ��������������ӵ�أ��ܷ�ӦΪ��FePO4+Li LiFePO4������еĹ������ʿɴ���Li+����õ�طŵ�ʱ������������Ӧʽ�ֱ�Ϊ�� �� �����øõ�ص������ˮ�����ص缫��Ϊ���Ե缫������������������3360mL���壨��״��������ʱ���õ������﮵�����Ϊ ��(Li�����ԭ������ԼΪ7.0)�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
��ͼΪ��ȡ����������ʵ��װ��ͼ���ش��������⣺ 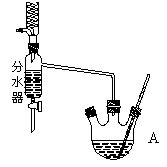
��ʾʵ��ԭ��
�������Ҵ��ڴ������ڵ������¼��ȿ��Է�����Ӧ��������������������ͬλ��ʾ�ٷ�д���������Ҵ�����������Ӧ�Ļ�ѧ����ʽ______________________��
�ܷ�����ͬλ��ʾ�ٷ���ʾ������Ӧԭ���� _______��ѡ��ܡ����ܡ�����ԭ����___________________��
��Ӧ�¶�ȷ����
�ϳ����������ķ�ӦΪ���ȷ�Ӧ��ʵ���������Ӧ�¶�Ӧ������85������Ϊ�ˡ��ش�
ʵ���¶Ȳ��˵���85�����ҵ�ԭ����__________________________________________��
ʵ���¶Ȳ��˸���85�����ҵ�ԭ����__________________________________________��
ʵ��װ�õıȽϣ�
������ͼװ���Ʊ���������������װ����̲�װ����Ƚ�ͻ�����ŵ���___________��
�����ȵı�ʾ��
Ϊ���õزⶨ�����ȣ���Ԥ����Na2CO3��Һ�еμ�1��____��Һ��������___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
��12�֣������ҹ�Ŀǰ����ҵ��չ�ٶ�,Ԥ��2020����������������2����,�й��ѳ�Ϊȫ�����������г�����ˣ������Ч���������ŷŵ�β��������Ҫ�����о���һ����Ҫ���⡣Ŀǰ���������̳����ô�������β���е�NO��COת����CO2��N2����ѧ����ʽ���£�
2NO��2CO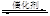 2CO2��N2��Ϊ�о������߸�ת�����̷�Ӧ���ʣ�ij���������������ʵ��̽����
2CO2��N2��Ϊ�о������߸�ת�����̷�Ӧ���ʣ�ij���������������ʵ��̽����
�����ϲ��ġ��ٲ�ͬ�Ĵ�����ͬһ��Ӧ�Ĵ�Ч�ʲ�ͬ��
��ʹ����ͬ�Ĵ������������������ʱ�������ıȱ�����Դ�Ч����Ӱ�졣
��ʵ����ơ�������Ϊ̽��ijЩ�������������β��ת����Ӧ���ʵ�Ӱ����ɣ���������¶Ա�ʵ�顣
��1���������ʵ����Ʊ������в�Ҫ���ո�
| ʵ���� | ʵ��Ŀ�� | T/�� | NO��ʼŨ�� mol/L | CO��ʼŨ�� mol/L | ͬ�ִ����ıȱ���� m2/g |
| �� | Ϊ����ʵ�������� | 280 | 6.50��10-3 | 4.00��10-3 | 80 |
| �� | | | | | 120 |
| �� | ̽���¶ȶ�β��ת�����ʵ�Ӱ�� | 360 | | | 80 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
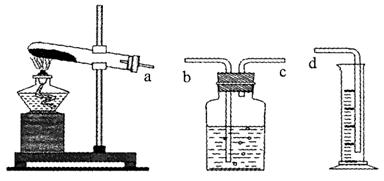
ijͬѧ��MnO2��CuO��Fe2O3��Cr2O3����������ȷֽⷴӦ�еĴ����ý������о���ʵ�������������±����ͱ�ʵ����й����⣬����գ�
| ʵ���� | KClO3��g�� | ������ | �������壨mL����������Ϊ����� | ��ʱ��s�� | ||
| ��ѧʽ | ������g�� | ʵ�ʻ��� | ||||
| 1 | 0.6 | �� | �� | �� | 10 | 480 |
| 2 | 0.6 | MnO2 | 0.20 | 90% | 67.2 | 36.5 |
| 3 | 0.6 | CuO | 0.20 | 90% | 67.2 | 79.5 |
| 4 | 0.6 | Fe2O3 | 0.20 | 90% | 67.2 | 34.7 |
| 5 | 0.6 | Cr2O3 | 0.20 | �쳣 | 67.2 | 188.3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
�����Ƕ�Ԫ���ᣬ���������Һ�����ԡ���0.1mol��L��1 KHC2O4��Һ�У����й�ϵ��ȷ����
| A��c(K+)+c(H+) = c(HC2O4��)+c(OH��)+c(C2O42��) |
| B��c(HC2O4��)+c (C2O42��) =" 0.1" mol��L��1 |
| C��c(C2O42��) < c(H2C2O4) |
| D��c(K+) = c(H2C2O4)+c(HC2O4��)+c(C2O42��) |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com