
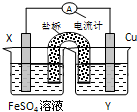
分析 根据反应“Cu2+(aq)+Fe(s)═Fe2+(aq)+Cu (s)”分析,在反应中,Fe被氧化,失电子,应为原电池的负极,正极为活泼性较Fe弱的Cu,Cu2+在正极上得电子被还原,电解质溶液为CuSO4溶液,原电池中,电流从正极经外电路流向负极,由此分析解答.
解答 解:(1)含有盐桥的原电池中,电极材料和相对应的电解质溶液具有相同的金属元素,所以X电极材料为Cu,Y电解质溶液为CuSO4溶液,
故答案为:CuSO4溶液;
(2)根据电池反应式知,Fe元素化合价由0价变为+2价,则Fe作负极,所以Cu作正极,正极Cu电极反应式为Cu2++2e-=Cu、负极反应式为 Fe-2e-=Fe2+,
故答案为:Cu2++2e-=Cu; Fe-2e-=Fe2+;
(3)放电时,电流从正极流向负极,即从Cu电极流向Fe电极;故答案为:Cu、Fe.
点评 本题考查了原电池原理,明确原电池中元素化合价升降与正负极的关系是解本题关键,再结合电子移动方向分析解答,题目难度不大.


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 1个 | B. | 2个 | C. | 3个 | D. | 4个 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
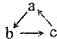 已知abc是中学常见的含有同种元素的三种物质,具有如图的转化关系(“→”表示在一定条件下可一步完成),下列各组物质中,不符合上述转化关系的是( )
已知abc是中学常见的含有同种元素的三种物质,具有如图的转化关系(“→”表示在一定条件下可一步完成),下列各组物质中,不符合上述转化关系的是( )| 选项 对应物质 | A | B | C | D |
| a | Cu(OH)2 | Na2O | Fe | Mg |
| b | CuCl2 | NaCl | FeCl3 | MgO |
| c | Cu | Na | FeCl2 | MgCl2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
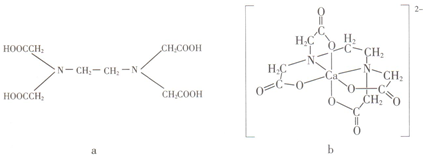
| A. | a和b中的N原子均为sp3杂化 | B. | b中Ca2+的配位数为4 | ||
| C. | b含有分子内氢键 | D. | b含有共价键、离子键和配位键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度能加快反应速率 | B. | 使用恰当的催化剂能加快反应速率 | ||
| C. | 增大压强能加快反应速率 | D. | N2与H2能100%转化为NH3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com