
| A. | C2H4O | B. | C2H5OH | C. | CH3CHO | D. | CH3COOH |
分析 有机物蒸气完全燃烧,产生二倍于其体积的二氧化碳,则分子中含有2个C原子,对于烃含氧衍生物CxHyOz,1mol耗氧量为(x+$\frac{y}{4}$-$\frac{z}{2}$)mol,有机物蒸气完全燃烧时需三倍于其体积的氧气,则(x+$\frac{y}{4}$-$\frac{z}{2}$)=3,结合各选项中分子式进行判断.
解答 解:有机物蒸气完全燃烧,产生二倍于其体积的二氧化碳,则分子中含有2个C原子,对于烃含氧衍生物CxHyOz,1mol耗氧量为(x+$\frac{y}{4}$-$\frac{z}{2}$)mol,有机物蒸气完全燃烧时需三倍于其体积的氧气,则(x+$\frac{y}{4}$-$\frac{z}{2}$)=3.
A.C2H4O分子含有2个碳原子,1mol消耗氧气为(2+$\frac{4}{4}$-0.5)mol=2.5mol,故A错误;
B.C2H5OH分子含有2个碳原子,1mol消耗氧气为(2+$\frac{6}{4}$-0.5)mol=3mol,故B正确;
C.CH3CHO分子含有2个碳原子,1mol消耗氧气为(2+1-0.5)mol=2.5mol,故C错误;
D.CH3COOH分子含有2个碳原子,1mol消耗氧气为(2+1-1)mol=2mol,故D错误,
故选:B.
点评 本题考查有机物分子式的确定,难度不大,注意根据原子守恒判断分子中碳原子数目及耗氧量规律,利用代入法验证.


 优生乐园系列答案
优生乐园系列答案 新编小学单元自测题系列答案
新编小学单元自测题系列答案科目:高中化学 来源: 题型:选择题

| A. | ①②④⑤ | B. | ①②③ | C. | ③④⑤ | D. | ②③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
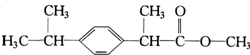 某种药物主要成分X的分子结构如图,关于有机物X的说法中错误的是( )
某种药物主要成分X的分子结构如图,关于有机物X的说法中错误的是( )| A. | ①④ | B. | ②④ | C. | ②③ | D. | ①② |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
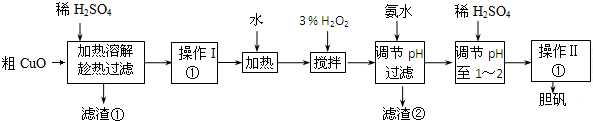
| Fe3+ | Fe2+ | Cu2+ | |
| 氢氧化物开始沉淀时的pH | 1.9 | 7.0 | 4.7 |
| 氢氧化物沉淀完全时的pH | 3.2 | 9.0 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 分子式 | 外观 | 热分解温度 | 熔点 | 溶解性 |
| CO(NH2)2•H2O2 | 白色晶体 | 45℃ | 75-85℃ | 易溶于水、有机溶剂 |
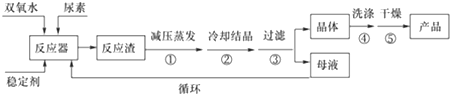
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸氢钠的电离方程式为:NaHCO3═Na++HCO3- HCO3-?H++CO32- | |
| B. | 偏铝酸钠的水解方程式为:AlO2-+2H2O═Al(OH)3↓+OH- | |
| C. | 硫化铝溶于水的水解方程式为:Al2S3+6H2O═2Al(OH)3↓+3H2S↑ | |
| D. | 醋酸铵的水解方程式为:CH3COO-+NH4++H2O?CH3COOH+NH3•H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
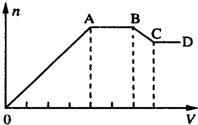 某溶液中,可能含有下表所列离子中的某几种:
某溶液中,可能含有下表所列离子中的某几种:| 阳离子 | Al3+、Mg2+、NH4+、Na+ |
| 阴离子 | CO32-、SiO32-、[Al(OH)4]-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解饱和NaOH溶液时溶液的pH变大 | |
| B. | 在镀件上电镀铜时,可以不用金属铜做阳极,只要溶液中存在Cu2+就可以 | |
| C. | 电解稀硫酸制O2、H2时,铜做阳极 | |
| D. | 铝-空气燃料电池通常以NaOH溶液为电解液,电池在工作过程中电解液的pH保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 溶液 | A | B | C | D | E |
| 5mol/LH2SO4 mL | 40 | V1 | V2 | V3 | V4 |
| 饱和CuSO4液 mL | 0 | 1 | 2 | V5 | 10 |
| H2O mL | V6 | V7 | V8 | 5 | 0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com