
 铝、铁和铜是生产、生活中应用最广泛的金属材料.
铝、铁和铜是生产、生活中应用最广泛的金属材料.分析 (1)根据盖斯定律把已知热化学方程式改写成目标方程式,结合反应热的关系计算;
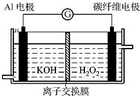
(2)负极反应是要消耗OH-,所以OH-要透过离子交换膜到负极区域;正极上双氧水得电子生成氢氧根离子;
(3)①电解精炼铜时,精铜做阴极,粗铜作阳极,阴极上是铜离子得电子;
②阳极上Cu以及活泼性大于铜的金属失电子;活泼性弱于Cu的金属不电解,会形成阳极泥.
解答 解:(1)已知反应①2Fe(s)+$\frac{3}{2}$O2(g)═Fe2O3(s)△H=-823.7kJ•mol-1
②2Al(s)+$\frac{3}{2}$O2(g)═Al2O3(s)△H=-1675.7kJ•mol-1
根据盖斯定律,将②-①可得:2Al(s)+Fe2O3(s)═Al2O3(s)+2Fe(s)△H=(-1675.7kJ•mol-1)-(-823.7kJ•mol-1)=-852.0kJ•mol-1,
(2)负极反应是要消耗OH-,OH-要透过离子交换膜到负极区域,正极上双氧水得电子生成氢氧根离子,则正极反应的离子方程式是H202+2e-=2OH-;
故答案为:OH-;H202+2e-=2OH-;
(3)①在电解精炼铜时,精铜做阴极,粗铜作阳极,阳极与外接电源的正极相连,阴极上是铜离子得电子产生铜,Cu2++2e=Cu,
故答案为:正;Cu2++2e=Cu;
②阳极上Cu以及活泼性大于铜的金属失电子,则阳极反应是金属锌、铁等先失电子,然后铜失电子,阴极上只有铜离子得电子,所以溶液中的铜离子浓度会变小;活泼性弱于Cu的金属不电解,则银、金不电解,会形成阳极泥;
故答案为:变小;银、金.
点评 本题考查了盖斯定律、原电池原理和电解池原理的应用,题目比较综合,侧重于考查学生的分析能力和计算能力,题目难度中等,注意把握原电池和电解池中电极的判断方法和电极方程式的书写方法.


科目:高中化学 来源: 题型:选择题
| 弱酸 | 醋酸 | 次氯酸 | 碳酸 | 亚硫酸 |
| 电离平衡常数 (25℃) | Ka=1.75ⅹ10-5 | Ka=2.98ⅹ10-8 | Ka1=4.3ⅹ10-7 Ka2=5.61ⅹ10-11 | Ka1=1.54ⅹ10-2 Ka2=1.02ⅹ10-7 |
| A. | 少量的CO2通入NaClO溶液中:CO2+H2O+2ClO-═CO32-+2HClO | |
| B. | 少量的SO2通入Na2CO3溶液中:SO2+H2O+2CO32-═SO32-+2HCO3- | |
| C. | 少量的SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-═CaSO3↓+2HClO | |
| D. | 相同浓度的NaHCO3溶液与NaHSO3溶液等体积混合:H++HCO3-═CO2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 图1:n (HCl)=1 mol,K2CO3逐步加入到HCl溶液中,在敞口容器中生成的气体 | |
| B. | 图2:n (NaOH)=1 mol,CO2逐步通入到NaOH溶液中反应生成的盐 | |
| C. | 图3:n (O2)=1 mol,高温下C和O2在密闭容器中的反应产物 | |
| D. | 图4:n (HNO3)=1 mol,Fe和稀HNO3反应生成的氧化产物(还原产物为NO) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
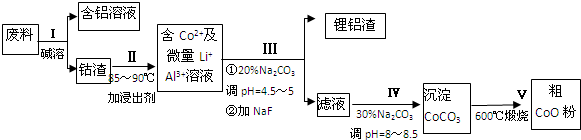
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
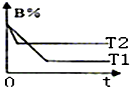 密闭容器中发生反应:A(g)+B(g)?C(g)△H.图中的两条曲线分别表示T1、T2温度下,体系中B的百分含量和时间t的关系.下列判断正确的是( )
密闭容器中发生反应:A(g)+B(g)?C(g)△H.图中的两条曲线分别表示T1、T2温度下,体系中B的百分含量和时间t的关系.下列判断正确的是( )| A. | △H<0,T1<T2 | B. | △H>0,T1<T2 | C. | △H<0,T1>T2 | D. | △H>0,T1>T2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稳定性:PH3>H2S>HCl | B. | 酸性:HClO4>HBrO4>HIO4 | ||
| C. | 非金属性:F>O>S | D. | 碱性:NaOH>Mg(OH)2>Al(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | |||
| 4 | ⑧ | ⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③⑤ | B. | ⑤⑦ | C. | ①④⑤ | D. | ②⑥⑦ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com