
【题目】取一定质量的氯化钠、溴化钠、碘化钠的混合物平均分成五等份,分别加水配成溶液并编号为甲、乙、丙、丁、戊,再分别向各溶液中通入一定体积的氯气,将反应后所得溶液蒸干,灼烧固体。通入氯气的量与最终所得固体质量记录如下:
编号 | 甲 | 乙 | 丙 | 丁 | 戊 |
固体组成 | NaI、NaBr、NaCl | NaBr、NaCl | NaCl | ||
氯气的体积/ml | V | 2V | 3V | 4V | 5V |
固体质量/g | 54.62 | 43.64 | 35.48 | 30.14 | 29.25 |
求:(1)请填写表中空白______________、____________;
(2)标准状况下氯气的体积V为_______,原混合物中溴化钠的物质的量为_______。
【答案】 乙:NaI、NaBr、NaCl 丁: NaBr、NaCl 1344 1mol
【解析】戊中固体NaCl质量29.25g,根据钠离子守恒得n(NaBr)+n(NaI)+n(NaCl)=![]() =0.5mol,由钠离子守恒可知反应后蒸干灼烧得到的固体的物质的量不变为0.5mol,
=0.5mol,由钠离子守恒可知反应后蒸干灼烧得到的固体的物质的量不变为0.5mol,
将反应甲至戊视作每次增加vml氯气计算,因还原性I->Br->Cl-,故先有2NaI+Cl2=2NaCl+I2…①,反应完后再有2NaBr+Cl2=2NaCl+Br2…②;
(1)对于乙视作甲增加vml氯气,导致固体质量减少为54.62g-43.64g=10.98g,因还原性I->Br->Cl-,故先有2NaI+Cl2=2NaCl+I2,反应完后再有2NaBr+Cl2=2NaCl+Br2。
vmL氯气与NaI反应导致固体质量减少最多
2NaI+Cl2=2NaCl+I2 固体减少
1mol 254g-71g=183g
0.06mol a
所以a=10.98g,等于甲通入vml氯气导致固体质量减少,所以乙最后通入vml氯气只与NaI反应,对于丙视作乙增加vmL氯气,导致固体质量减少为43.64g-35.48=8.16g,vmL氯气与NaBr反应导致固体质量减少最少为35.48g-30.14g=5.34g,小于8.16g,故丙中最后vmL氯气,既与NaI反应又与NaBr反应。由上述分析可得:固体乙的组成为NaI、NaBr、NaCl;对于戊视作丁增加vmL氯气,蒸干灼烧得到固体的质量还在减少,结合丙固体的组成为NaBr、NaCl,说明丁固体的组成为NaBr、NaCl;(2)丁中最后vmL氯气与NaBr反应,vmL氯气完全反应,且有NaBr剩余,令vmL氯气的物质的量为n,则
Cl2+2NaBr=2NaCl+Br2 固体减少
1mol 160g-71g=89g
n 35.48g-30.14g=5.34g
所以n=0.06mol,即vml氯气的物质的量为0.06mol,标准状况下体积为0.06mol×22.4L/mol=1.344L=1344mL;由于乙最后通入vmL氯气只与NaI反应,甲通入vmL氯气导致固体质量减少等于乙最后通入vmL氯气导致固体质量减少,所以原溶液中NaI与NaBr的总质量为54.62g+10.98g=65.6g,令原溶液中NaI的物质的量为xmol,NaBr的物质的量为ymol,则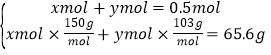 ,解得x=0.3,y=0.2,则原来混合物中溴化钠的物质的量=0.2mol×5=1mol。
,解得x=0.3,y=0.2,则原来混合物中溴化钠的物质的量=0.2mol×5=1mol。


 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案科目:高中化学 来源: 题型:
【题目】某温度下,向一定体积0.1mol/L醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH(pOH=﹣lg[OH﹣])与pH的变化关系如图所示,则( ) 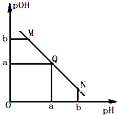
A.M点所示溶液导电能力强于Q点
B.N点所示溶液中c(CH3COO﹣)>c(Na+)
C.M点和N点所示溶液中水的电离程度相同
D.Q点消耗NaOH溶液的体积等于醋酸溶液的体积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.同一周期相邻主族的两种元素的原子序数之差一定是1
B.同一主族的两种元素的原子序数之差可能是36
C.同一主族相邻周期的两种元素的原子序数之差可能是26
D.同一主族相邻周期的两种元素的原子序数之差都相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气是一种重要的化工原料,自来水的消毒、农药的生产、药物的合成等都需要用到氯气。
I.工业上通常采用电解法制氯气:观察下图,回答:

(1)若饱和食盐水中含有酚酞,通电后_____(填a或b)侧先变红。
(2)电解反应的化学方程式为_______________________。
II. 某学生设计如下图所示的实验装置,利用氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应),据此回答下列问题:

(1)在A装置中用固体二氧化锰与浓盐酸在加热条件下制取氯气,反应化学方程式为_________________________________________
(2)漂白粉将在U形管中产生,其化学方程式是__________________________________。
(3)C装置的作用是_____________________。
(4)此实验所得漂白粉的有效成分偏低,该学生经分析并查阅资料发现,主要原因是在U形管中还存在两个副反应。
①温度较高时氯气与消石灰反应生成Ca(ClO3)2,为避免此副反应的发生,可采取的措施是_________________________________。
②试判断另一个副反应(用化学方程式表示)_______________________________________。为避免此副反应的发生,可将装置作何改进_____________________________________。
(5)家庭中使用漂白粉时,为了增强漂白能力,可加入少量的物质是______________。
A.食盐 B.食醋 C.烧碱 D.纯碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,pH=10的X、Y两种碱溶液各1mL,分别加水稀释到100mL,其pH与溶液体积(V)的关系如图所示,下列说法正确的是( ) 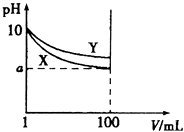
A.稀释前,两种碱溶液中溶质的物质的量浓度一定相等
B.稀释后,X溶液的碱性比Y溶液的碱性强
C.完全中和X、Y溶液时,消耗同浓度盐酸的体积VX>VY
D.若8<a<10,则X、Y都是弱碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于氢键,下列说法正确是( )
A.所有含氢元素的化合物中都存在氢键,氢键比范德华力强
B.H2O是一种非常稳定的化合物,就是由于水分子间形成氢键所致
C.氢原子和非金属性很强的元素原子(F、O、N)形成的共价键,称为氢键
D.分子间形成的氢键使相应物质的熔点和沸点升高,氢键也可存在于分子内
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数,下列说法正确的是( )
A. 1 mol NaHCO3与足量盐酸反应放出CO2气体的体积为22.4L
B. 1 mol Al3+离子含有的核外电子数为3NA
C. O2和O3的混合气体,质量为48g,所含氧原子数为3NA
D. 高温下,0.2mol Fe与足量水蒸气反应,生成的H2的分子数目为0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常见物质A~K之间存在如下图所示的转化关系,其中D、E为单质,请回答下列问题(图中有些反应的产物和反应的条件没有全部标出)。

(1)写出下列物质中溶质的名称:B是 __________,G是____________
(2)反应“F→G”的化学方程式是_____________________________________________
(3)反应“J→I”的离子方程式是_____________________________________________
(4)溶液I中混有溶液J,除去J的方法是:________________________________________________________________
(5)检验溶液I中阳离子的方法是:__________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com