
下列反应的离子方程式书写正确的是
A.制备乙酸乙酯时将产生的蒸气导入饱和碳酸钠溶液:C+2H+ CO2↑+H2O
CO2↑+H2O
B.用惰性电极电解饱和食盐水:2Cl-+2H+ H2↑+Cl2↑
H2↑+Cl2↑
C.向含有0.4 mol FeBr2的溶液中通入0.3 mol Cl2充分反应:2Fe2++4Br-+3Cl2 2Fe3++6Cl-+2Br2
2Fe3++6Cl-+2Br2
D.饱和Ca(OH)2溶液中加入少量NaHCO3溶液:Ca2++OH-+HC CaCO3↓+H2O
CaCO3↓+H2O
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2015-2016学年辽宁大连经济技术开发区得胜高中高二下期中化学试卷(解析版) 题型:选择题
用NA表示阿伏加德罗常数,下列叙述中正确的是( )
A.在标准状态下,1L庚烷完全燃烧后,所生成的气态产物的分子数为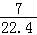 NA
NA
B.1mol碳正离子CH5+所含的电子数为11NA
C.标准状态下,16g甲烷完全燃烧所消耗的氧气的分子数为2NA
D.0.5molC3H8分子中含C﹣H共价键2NA
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省衡水市高一下3月月考化学试卷(解析版) 题型:选择题
俄罗斯科学家最近合成第114号元素的原子,该原子的质量数为289,存在时间达到30秒,这项成果具有重要意义.该原子的中子数与质子数之差是( )
A. 175 B. 114 C. 61 D. 289
查看答案和解析>>
科目:高中化学 来源:2015-2016学年海南省国科园实验学校高二下期中化学试卷(解析版) 题型:选择题
1体积某气态烃和2体积氯化氢发生加成反应后,最多还能和6体积氯气发生取代反应.由此可以断定原气态烃是(气体体积均在相同条件下测定)( )
A.乙炔 B.丙炔 C.丁炔 D.丁二烯
查看答案和解析>>
科目:高中化学 来源:2017届四川省高三7月暑期摸底检测化学试卷(解析版) 题型:实验题
某化学小组以苯甲酸为原料,制取苯甲酸甲酯。已知有关物质的沸点如下:
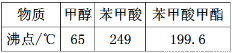
Ⅰ.合成苯甲酸甲酯粗产品
在圆底烧瓶中加入3 mL浓硫酸、12.2 g苯甲酸、20 mL甲醇(密度约为0.79 g/cm3)。
(1)液体混合时,正确的加入顺序是 。
(2)为防止圆底烧瓶中的液体在实验时发生暴沸,在加热前应采取的措施是 。
(3)在该反应中反应物甲醇应过量,其理由是 。
Ⅱ.粗产品的精制
(4)现拟用下列流程精制苯甲酸甲酯,请根据流程图填入恰当操作方法的名称:操作1为 ,操作2为 。
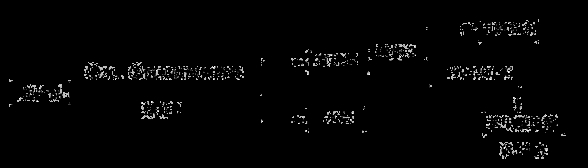
(5)苯甲酸甲酯的产率为 。
(6)苯甲酸甲酯粗产品中往往含有少量甲醇、硫酸、苯甲酸和水等,某同学做了如下检验。
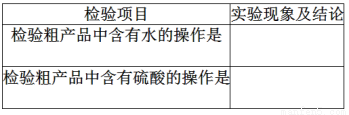
查看答案和解析>>
科目:高中化学 来源:2016届浙江省高三上学期第一次月考化学试卷(解析版) 题型:填空题
(1)有以下八种饱和溶液:①Ba(NO3)2;②Ca(OH)2;③Ca(ClO)2;④CaCl2;⑤Na2CO3;⑥NaAlO2;⑦NH3和NaCl;⑧Na2SiO3。向其中分别持续通入CO2,最终能得到沉淀或析出晶体的__ 。
(2)根据下列描述写出下列化学方程式:
①已知ZnO属于两性氧化物,写出ZnO与NaOH溶液反应的离子方程式: 。
② 联氨(N2H4)是航天飞船常用的高能燃料。联氨可以采用尿素CO(NH2)2]为原料制取,方法是在高锰酸钾催化剂存在下,尿素【CO(NH2)2】和次氯酸钠、氢氧化钠溶液反应生成联氨、碳酸钠、另一种钠盐和水,写出其反应的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源:2016届浙江省高三上学期第一次月考化学试卷(解析版) 题型:选择题
下列各项操作中,不发生“先产生沉淀,然后沉淀又溶解”现象的是
①向饱和碳酸钠溶液中通入过量CO2
②向NaAlO2溶液中逐滴加入过量的稀盐酸
③向AlCl3溶液中逐滴加入过量稀NaOH溶液
④向硅酸钠溶液中逐滴加入过量的盐酸
⑤向AgNO3溶液中逐滴加入稀氨水
A.①② B.②③ C.①④ D.④⑤
查看答案和解析>>
科目:高中化学 来源:2016届浙江省高三上学期第一次月考化学试卷(解析版) 题型:选择题
分类是科学研究的重要方法,下列物质分类不正确的是
A.化合物:干冰,冰水混合物,烧碱,小苏打
B.非电解质:乙醇,四氯化碳,氯气,葡萄糖
C.同素异形体:活性炭,C60,石墨烯,金刚石
D.混合物:铝热剂,纯净矿泉水,水玻璃,漂白粉
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河南省三门峡市高二下第一次月考化学试卷(解析版) 题型:填空题
(1)已知X、Y、Z为第三周期元素,其原子的第一至第四电离能如下表:
电离能/kJ•mol﹣1 I1 I2 I3 I4
X 578 1 817 2 745 11 578
Y 738 1 451 7 733 10 540
Z 496 4 562 6 912 9 543
则X、Y、Z的电负性从大到小的顺序为 (用元素符号表示),元素Y的第一电离能大于X的第一电离能原因是 .
(2)A、B、C、D是周期表中前10号元素,它们的原子半径依次减小.D能分别与A、B、C形成XYn型的电子总数相等的分子M、N、W,且在M、N、W分子中,A、B、C 三原子都采取sp3杂化.
①A、B、C的第一电离能由小到大的顺序为 (用元素符号表示).
②M是含有 键(填“极性”或“非极性”)的 分子(填“极性”或“非极性”).
③N是一种易液化的气体,请简述其易液化的原因 .
④W分子的VSEPR模型的空间构型为 ,W分子的空间构型为 .
⑤AB﹣离子中和B2分子的π键数目比为 .
(3)E、F、G三元素的原子序数依次增大,三原子的核外的最外层电子排布均为4s1.
①F元素在其化合物中最高化合价为 .
②G2+离子的核外电子排布式为 ,G2+和N分子形成的配离子的结构式为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com