
【题目】利用如图所示的装置和其他必要的仪器用品,完成下列实验。

已知2NH3+3CuO![]() N2+3Cu+3H2O,该实验证明氨气具有还原性。
N2+3Cu+3H2O,该实验证明氨气具有还原性。
(1)碱石灰的作用是______________,倒扣漏斗的作用是___________________。
(2)浓氨水与固体NaOH接触,会逸出大量氨气原因是______________________。
(3)硬质玻璃管中可观察到的实验现象是_________________________________。
(4)常温下,若氨水与稀硫酸恰好完全中和,则所得溶液中各离子浓度的大小顺序为_________。
【答案】吸收水蒸气 防止倒吸 NaOH吸水放热,使溶液温度升高,有利于NH3·H2O分解;c(OH-)增大,使NH3+H2O![]() NH4++OH—平衡左移,也有利于氨气的逸出 黑色粉末变为红色,有无色液滴产生 c(NH+4)>c(SO42—)>c(H+)>c(OH-)
NH4++OH—平衡左移,也有利于氨气的逸出 黑色粉末变为红色,有无色液滴产生 c(NH+4)>c(SO42—)>c(H+)>c(OH-)
【解析】
要证明NH3的还原性,需要NH3和氧化性的物质反应,本题选择的是CuO,CuO和NH3反应生成Cu,看到黑色的CuO变成了红色的Cu,可证明NH3的还原性。首先需要制备NH3,用浓氨水和NaOH溶液制备,产生的NH3经碱石灰干燥后进入硬质玻璃管和CuO反应,剩余的NH3用稀硫酸吸收,以防污染环境。
(1)制取的氨气中含有水蒸气,氨气与氧化铜反应需要加热,所以氨气进入硬质试管前应进行干燥,所以碱石灰作用为干燥氨气;吸收过量的氨气防止空气污染,氨气极易被浓硫酸吸收,应防止发生倒吸;故答案为干燥氨气;防止发生倒吸;
(2)一水合氨中存在平衡NH3·H2O![]() NH3↑+H2O,且该反应是吸热反应,向浓氨水中加入NaOH固体,氢氧化钠溶解放出热量促进一水合氨分解生成氨气,另外c(OH-)增大,使NH3+H2O
NH3↑+H2O,且该反应是吸热反应,向浓氨水中加入NaOH固体,氢氧化钠溶解放出热量促进一水合氨分解生成氨气,另外c(OH-)增大,使NH3+H2O![]() NH4++OH—平衡左移,也有利于氨气的逸出。故答案为:NaOH吸水放热,使溶液温度升高,有利于NH3·H2O分解;c(OH-)增大,使NH3+H2O
NH4++OH—平衡左移,也有利于氨气的逸出。故答案为:NaOH吸水放热,使溶液温度升高,有利于NH3·H2O分解;c(OH-)增大,使NH3+H2O![]() NH4++OH—平衡左移,也有利于氨气的逸出;
NH4++OH—平衡左移,也有利于氨气的逸出;
(3)氨气与氧化铜发生氧化还原反应,生成产物为铜,同时生成水,看到现象为:黑色粉末变为红色,有无色液滴产生,故答案:为黑色粉末变为红色,有无色液滴产生;
(4)氨水与稀硫酸恰好完全中和生成硫酸铵,NH4+水解溶液呈酸性,水解是微弱的,所得溶液中各离子浓度的大小顺序为(NH4+)>c(SO42—)>c(H+)>c(OH-),故答案为(NH+4)>c(SO42—)>c(H+)>c(OH-)。


科目:高中化学 来源: 题型:
【题目】已知: RX+Mg![]() RMgX (RX为卤代烃,X为卤族原子),生成的卤代烃基镁与具有羰基结构的化合物(醛、酮等)发生反应,再水解就能合成各种指定结构的醇:
RMgX (RX为卤代烃,X为卤族原子),生成的卤代烃基镁与具有羰基结构的化合物(醛、酮等)发生反应,再水解就能合成各种指定结构的醇:

现以2-丁烯和必要的无机物为原料合成F,进而合成一种分子式为C10H16O4的具有六元环的物质J,合成线路如下:(G的核磁共振氢谱有三组峰)
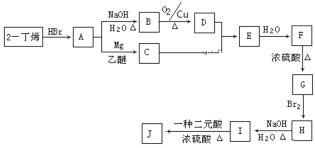
请按要求填空:
(1)F的系统命名:___________________________,E的结构简式是_________________________
(2)C→E的反应类型是______________,F→G的反应类型是___________________
(3)写出I→J化学反应方程式:___________________________________________
(4)A的同分异构体共有______种
(5)M为D的同分异构体且能发生银镜反应,写出所有M的结构简式_______________;其中核磁共振氢谱中出现3组峰的物质与新制氢氧化铜悬浊液在煮沸条件下发生反应的方程式为:______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】O3也是一种很好的消毒剂,具有高效、洁净、方便、经济等优点。O3可溶于水,在水中易分解,产生的[O]为游离氧原子,有很强的杀菌消毒能力。常温常压下发生反应如下:反应①O3![]() O2+[O]ΔH>0平衡常数为K1;反应②[O]+O3
O2+[O]ΔH>0平衡常数为K1;反应②[O]+O3![]() 2O2ΔH<0平衡常数为K2;总反应:2O3
2O2ΔH<0平衡常数为K2;总反应:2O3![]() 3O2ΔH<0衡常数为K。下列叙述正确的是( )
3O2ΔH<0衡常数为K。下列叙述正确的是( )
A.升高温度,K增大B.K=K1+K2
C.适当升温,可提高消毒效率D.压强增大,K2减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛是一种重要的金属,以钛铁矿[主要成分为钛酸亚铁(FeTiO3),还含有少量Fe2O3]为原料制备钛的工艺流程如图所示。
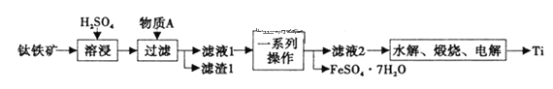
(1)滤液1中钛元素以TiO2+形式存在,则“溶浸”过程发生的主要反应的化学方程式为___。
(2)物质A为___(填化学式),“一系列操作”为___。
(3)“水解”步骤中生成TiO2·xH2O,为提高TiO2·xH2O的产率,可采取的措施有___、___。(写出两条)。
(4)将少量FeSO4·7H2O溶于水,加入一定量的NaHCO3溶液,可制得FeCO3,写出反应的离子方程式___;若反应后的溶液中c(Fe2+)=2×10-6mol·L-1,则溶液中c(CO32-)=___mol·L-1。(已知:KSP(FeCO3)=2.025×10-11)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组用如图所示装置探究金属锌和稀硫酸的反应,实验过程中电流表的指针发生偏转。请回答下列问题:
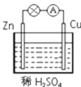
(1)锌片做电池的__________极(填“正或负”),发生的电极反应式:__________。
(2)铜片的现象是__________,发生的电极反应式:__________。
(3)若将稀H2SO4换成CuSO4,则正极反应式为:__________。
(4)若将电极换成铁片和铜片,则负极是__________(填“铁片或铜片”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磺酰氯(SO2Cl2)是一种有机氯化剂,也是锂电池正极活性物质。已知磺酰氯是一种无色液体,熔点-54.1℃,沸点69.1℃,遇水发生剧烈水解,且产生白雾。
(1)SO2Cl2水解的方程式为_______________________________________________
(2)某学习小组的同学依据反应:SO2(g)+ Cl2(g)![]() SO2Cl2(g);△H <0,设计制备磺酰氯装置如图:
SO2Cl2(g);△H <0,设计制备磺酰氯装置如图:
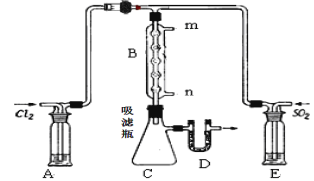
①E中所用的试剂为________________
②实验室用Na2SO3和硫酸制备SO2,可选用的气体发生装置是____(选填编号);检查该装置气密性的操作是:关闭止水夹,再___________________________________

③B处反应管内五球中玻璃棉上的活性炭的作用为:_______________________D处U形管中盛放的试剂为_________________,作用 :________________________
(3)已知:以下三个反应的反应热,a、b、c均为正值
①SO2(g)+Cl2(g)+SCl2(g) ![]() 2SOCl2(g) △H=-akJ·mol-1
2SOCl2(g) △H=-akJ·mol-1
②SO2Cl2(g)+SCl2(g) ![]() 2SOCl2(g) △H=-bkJ·mol-1
2SOCl2(g) △H=-bkJ·mol-1
③SO2Cl2(l) ![]() SO2Cl2(g) △H= + ckJ·mol-1
SO2Cl2(g) △H= + ckJ·mol-1
则反应:SO2(g)+Cl2(g) ![]() SO2Cl2(l) △H=______________kJ·mol-1(用含a、b、c的代数式表示);该反应平衡常数表达式为K=___________。从化学平衡移动角度分析,反应管通水冷却的目的为____
SO2Cl2(l) △H=______________kJ·mol-1(用含a、b、c的代数式表示);该反应平衡常数表达式为K=___________。从化学平衡移动角度分析,反应管通水冷却的目的为____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据媒体报道,法国一家公司Tiamat日前研发出比当前广泛使用的锂电池成本更低、寿命更长、充电速度更快的钠离子电池,预计从2020年开始实现工业生产。该电池的负极材料为![]() 制备原料为
制备原料为![]() 、
、![]() 和
和![]() ,电解液为
,电解液为![]() 的碳酸丙烯酯溶液。
的碳酸丙烯酯溶液。
回答下列问题:
(1)Te属于元素周期表中______区元素,其基态原子的价电子排布式为______。
(2)基态Na原子中,核外电子占据的原子轨道总数为______。
(3)结合题中信息判断:C、O、Cl的电负性由大到小的顺序为______![]() 用元素符号表示
用元素符号表示![]() 。
。
(4)碳酸丙烯酯的结构简式如下图所示,则其中碳原子的杂化轨道类型为______,1mol碳酸丙烯酯中σ键的数目为______。

![]() 的几何构型为正八面体形,配体是______,该配离子包含的作用力为______
的几何构型为正八面体形,配体是______,该配离子包含的作用力为______![]() 填选项字母
填选项字母![]() 。
。
A.离子键 B.极性键 C.配位键 D.氢键 E.金属键
(6)Na和O形成的离子化合物的晶胞结构如下图所示,该晶胞的密度为ρg/![]() ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为![]() ,则Na与O之间的最短距离为_______________________
,则Na与O之间的最短距离为_______________________ ![]() 用含ρ、
用含ρ、![]() 的代数式表示
的代数式表示![]() 。
。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积恒定的密闭容器中,1 mol A(g)与1 mol B(g)在催化剂作用下加热到500 ℃发生反应:A(g)+nB(g)![]() C(g)+D(g) ΔH>0达到平衡,下列判断正确的是( )
C(g)+D(g) ΔH>0达到平衡,下列判断正确的是( )
A.升高温度v(正)增大,v(逆)减小,平衡向正反应方向移动
B.平衡后再加入1 mol B,上述反应的ΔH增大
C.当n<1时,通入惰性气体,压强增大,平衡向逆反应方向移动
D.若n=1且A的转化率为50%,则平衡常数等于1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于有机物的叙述正确的是( )
A.丙烷的二卤代物是4种,则其六卤代物是2种
B.某烃的同分异构体只能形成一种一氯代物,其分子式一定为C5H12
C.甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得产物有6种
D.对二甲苯的核磁共振氢谱显示有3种不同化学环境的氢
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com