
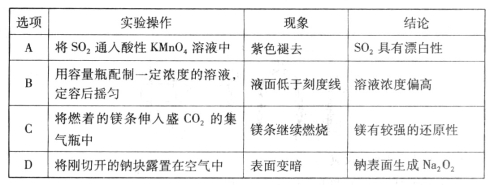
下列实验操作、现象及结论均正确的是
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2014-2015学年内蒙古巴市高二10月月考化学试卷(解析版) 题型:填空题
现有反应aA(g)+bB(g)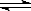 pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
(1)该反应的逆反应是_______热反应,且a+b______p(填“>”“<”或“=”)。
(2)减压时,A的质量分数________(填“增大”“减小”或“不变”,下同),正反应速率________。
(3)若加入B(体积不变),则A的转化率________,B的转化率________。
(4)若升高温度,则平衡时,B、C的浓度之比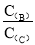 将________。
将________。
(5)若加入催化剂,平衡时气体混合物的总物质的量________。
(6)若B是有色物质,A、C均为无色物质,则加入C(体积不变)时混合物的颜色________,而维持容器体积不变,充入氖气时,混合物的颜色________(填“变浅”“变深”或“不变”)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省高三上学期期中考试化学试卷(解析版) 题型:选择题
A、B、C、D、E是5种短周期元素,其原子序数依次增大。A是周期表中原子半径最小的元素,B原子最外层电子数是次外层电子数的3倍,C、D、E处于同一周期,E与B处于同一族,C、D原子的核外电子数之和与B、E原子的核外电子数之和相等。下列说法正确的是
A.元素B、C、D具有相同电子层结构的离子,其半径依次增大
B.元素A不能与元素B形成化合物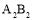
C.元素B、E分别与元素A形成的化合物的热稳定性: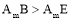
D.元素D、E的最高价氧化物的水化物都是强酸
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省潍坊市高三上学期期中考试化学试卷(解析版) 题型:选择题
11.2 g Cu在某浓硝酸中完全溶解,反应产生NO2和NO混合气体3.36L(标准状况),则混合气体中NO2和NO的体积比为
A.1:l B.1:2 C.1:3 D.2:l
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省潍坊市高三上学期期中考试化学试卷(解析版) 题型:选择题
某同学组装如图所示电化学装置,电极I为Zn,其它电极均为Cu。下列说法错误的是
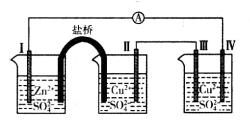
A.电极I发生氧化反应
B.相同的时间内,电极Ⅱ与Ⅳ质量变化相同
C.电极III的电极反应:4OH――4e-=2H2O+O2↑
D.电流方向:电极Ⅳ→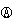 →电极I
→电极I
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省盐城市高三第二次调研考试化学试卷(解析版) 题型:填空题
(10分)科学家认为,氢气是一种高效而无污染的理想能源,近20年来,对以氢气作为未来的动力燃料氢能源的研究获得了迅速发展。
(1)为了有效发展民用氢能源,首先必须制得廉价的氢气,下列可供开发又较经济且资源可持续利用的制氢气的方法是 。(选填字母)
A.电解水 B.锌和稀硫酸反应
C.光解海水 D.分解天然气
(2)用水分解获得氢气的能量变化如图所示,表示使用催化剂是曲线 。该反应为 (放热还是吸热)反应。

(3)1g的氢气完全燃烧生成液态水释放出142.9kJ的热量.写出其完全燃烧的热化学方程式: 。
(4)氢氧燃料电池能量转化率高,具有广阔的发展前景。现用氢氧燃料电池进行下图所示实验:
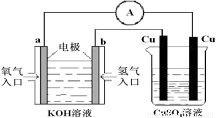
上图装置中,某一铜电极的质量减轻 6.4g ,则 a 极上消耗的O2在标准状况下的体积为 L。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省盐城市高三第二次调研考试化学试卷(解析版) 题型:选择题
如图是某硫酸试剂瓶的标签上的部分信息。下列说法正确的是

A.常温下,该试剂可与金属铝反应生成大量的无色气体
B.1 mol Zn与足量的该硫酸反应生成2 g氢气
C.该硫酸与等体积水混合所得溶液的物质的量浓度大于9.2 mol/L
D.向50 mL该硫酸中加入足量的铜片,加热,反应后被还原的硫酸的物质的量小于0.46 mol
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省无锡市高三期中化学试卷(解析版) 题型:填空题
(15分)光刻胶是一种应用广泛的光敏材料,其合成路线如下(部分试剂和产物略去):
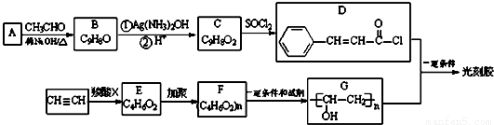
已知:A是苯甲醛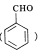
Ⅰ.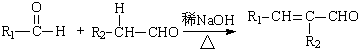 (R,R′为烃基或氢)
(R,R′为烃基或氢)
Ⅱ. (R,R′为烃基)
(R,R′为烃基)
(1)C分子中所含官能团名称为 。
(2)乙炔和羧酸X加成生成E,E的核磁共振氢谱为三组峰,且峰面积比为3:2:1,E能发生水解反应,则E的结构简式为 。
(3)由C到D的反应类型为 。
(4)D和G反应生成光刻胶的化学方程式为 。
(5)C的一种同分异构体满足下列条件:
①能发生银镜反应,其水解产物之一能与FeCl3溶液发生显色反应;
②苯环上的一氯取代产物只有两种。
写出该同分异构体的结构简式: 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省连云港市高三上学期期中化学试卷(解析版) 题型:填空题
(16分)为了测定实验室长期存放的Na2SO3固体的纯度,准确称取W g固体样品,配成250 mL溶液。设计了以下两种实验方案:
方案I:取25.00 mL上述溶液,加入过量的盐酸酸化的BaCl2溶液,过滤、洗涤和干燥沉淀,称得沉淀的质量为m1 g 。
方案Ⅱ:取25.00 mL上述溶液,加入过量的硝酸酸化的Ba(NO3)2溶液,过滤、洗涤和干燥沉淀,称重,其质量为m2 g 。
(1)准确配制250 mL Na2SO3溶液时,必须用到的实验仪器有:天平、烧杯、玻棒、胶头滴管、药匙和___。
(2)写出Na2SO3固体氧化变质的化学方程式 _。
(3)方案I加入过量的盐酸酸化的BaCl2溶液,如何检验是否沉淀完全,其操作是_ __。
(4)方案I中,若滤液浑浊,将导致测定结果_ ___(选填“偏高”或“偏低”)。
(5)由方案I :Na2SO3固体的纯度可表示为:
(6)方案I、方案Ⅱ :m1 m2(填“>”、“<”或“=”)
(7)取25.00 mL上述溶液,用滴定的方法测定Na2SO3的纯度。下列试剂可作为标准溶液进行滴定的是_ __。
A.酸性KMnO4溶液 B.H2O2溶液 C.Br2水 D.FeCl3溶液
滴定终点的现象为___________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com