
| A. | Zn电极上发生的反应为:2H++2e-═H2↑ | |
| B. | H+向Zn电极移动 | |
| C. | 溶液的c(H+)减小 | |
| D. | 电子由Cu转移到Zn |
分析 锌、铜和稀硫酸组成的原电池中,活泼性较强的锌为原电池的负极,发生:Zn-2e-=Zn2+而被氧化,原电池工作时,电子由负极经外电路流向正极,电解质溶液中,H+流向正极,在Cu棒上得电子被还原为氢气,以此解答该题.
解答 解:A.锌为原电池的负极,发生:Zn-2e-=Zn2+而被氧化,故A错误;
B.电解质溶液中,H+流向正极,在Cu棒上得电子被还原为氢气,故B错误;
C.氢离子在正极被还原生成氢气,则溶液的c(H+)减小,故C正确;
D.原电池工作时,电子由负极经外电路流向正极,即电子由Zn经外电路流向Cu,故D错误.
故选C.
点评 本题考查原电池和电解池知识,侧重于学生的分析能力和电化学知识的综合考查,为高考常见题型和高频考点,注意把握电解方程式的书写,难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
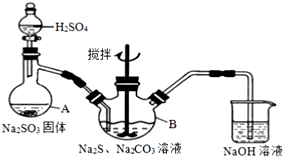 硫代硫酸钠(Na2S2O3)是一种重要的化工产品.某兴趣小组在查阅资料后制备Na2S2O3,结合其性质进行了实验探究.
硫代硫酸钠(Na2S2O3)是一种重要的化工产品.某兴趣小组在查阅资料后制备Na2S2O3,结合其性质进行了实验探究.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过氧化钠既是氧化剂又是还原剂 | |
| B. | 3摩尔过氧化钠发生反应,有12摩尔电子转移 | |
| C. | 在高铁酸钠中铁为+4价,具有强氧化性,能消毒杀菌 | |
| D. | 高铁酸钠既是氧化产物又是还原产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制0.1mol•L-1NaOH溶液过程中,将NaOH固体放在滤纸上称量 | |
| B. | 配制0.1mol•L-1的H2SO4溶液时,将量取的浓H2SO4放入容量瓶中加水稀释 | |
| C. | 配制0.1mol•L-1的NaCl溶液时,最后用胶头滴管加水至刻度线 | |
| D. | 配制0.1mol•L-1的HCl溶液时,要将量取浓盐酸的量筒和溶解用的烧杯洗涤2~3次,并将洗涤液转入容量瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
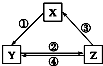 不能实现如图所示的变化的是( )
不能实现如图所示的变化的是( ) | 选项 | X | Y | Z | 箭头上所标数字的反应条件 |
| A | CaO | Ca(OH)2 | CaCO3 | ①常温遇水 |
| B | AlCl3 | NaAlO2 | Al(OH)3 | ②通入CO2 |
| C | Na2CO3 | NaOH | NaHCO3 | ④过量Ca(OH)2溶液 |
| D | Cl2 | Ca(ClO)2 | HClO | ③加浓盐酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
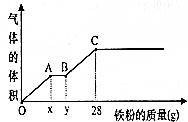 将400mL稀硫酸和稀硝酸的混合溶液平分成两份.向其中一份中逐渐加入铜粉,最多能溶解19.2g铜,且反应后溶液中还有硫酸剩余;向另一份中逐渐加入铁粉,产生气体的体积和所加铁粉质量的变化关系如图所示.请回答下列问题(假设硝酸只被还原为NO气体):
将400mL稀硫酸和稀硝酸的混合溶液平分成两份.向其中一份中逐渐加入铜粉,最多能溶解19.2g铜,且反应后溶液中还有硫酸剩余;向另一份中逐渐加入铁粉,产生气体的体积和所加铁粉质量的变化关系如图所示.请回答下列问题(假设硝酸只被还原为NO气体):查看答案和解析>>
科目:高中化学 来源: 题型:解答题
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com