
| A.两者对应反应的△H均小于0 |
| B.两者的单位均为kJ·mol-1,但mol-1的含义不同 |
| C.两者的数值均不随反应物用量改变而改变 |
| D.两者的数值均随反应物改变而改变 |
 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源:不详 题型:单选题
 2SO3(g)ΔH =" -197" kJ/mol。实验测得起始、平衡时的有关数
2SO3(g)ΔH =" -197" kJ/mol。实验测得起始、平衡时的有关数| 容器 | 起始各物质的物质的量/mol | 达到平衡时体系能量的变化 | ||
| SO2 | O2 | Ar | ||
| 甲 | 2 | 1 | 0 | 放出热量:Q1 |
| 乙 | 2 | 1 | 0 | 放出热量:Q2 |
| 丙 | 2 | 1 | 0.5 | 放出热量:Q3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.△H1<△H2=△H3 | B.△H1>△H2>△H3 |
| C.△H1>△H2=△H3 | D.△H1=△H2<△H3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.2H2 +O2 2H2O 2H2O | B.CaO + H2O= Ca(OH)2 |
C.CaCO3 CaO + CO2↑ CaO + CO2↑ | D.CH3CH2OH(酒精)+ 3O2 2CO2 + 3 H2O 2CO2 + 3 H2O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.a<c<0 | B.b>d>0 | C.2a=b<0 | D.2c=d>0 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 I3-(aq)+2SO42-(aq)+Q
I3-(aq)+2SO42-(aq)+Q
| 实验编号 | ① | ② | ③ | ④ | ⑤ |
| c(I-)/mol·L-1 | 0.040 | 0.080 | 0.080 | 0.160 | 0.160 |
| c(S2O82-)/mol·L-1 | 0.040 | 0.040 | 0.080 | 0.080 | 0.040 |
| t/s | 88 | 44 | 22 | 11 | t1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
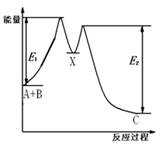
| A.E2表示反应X→C的活化能 |
| B.反应A+B→C的△H<0 |
| C.X是反应A+B→C的催化剂 |
| D.加入催化剂可改变反应A+B→C的焓变 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.化学反应中的能量变化,表现形式除热量外还可以是光能和电能等 |
| B.化学反应中的能量变化不一定服从能量守恒定律 |
| C.在一个确定的化学反应关系中,反应物的总能量与生成物的总能量可能相同 |
| D.在一个确定的化学反应关系中,反应物的总能量总是高于生成物的总能量 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.生成物总能量一定低于反应物总能量 |
| B.放热反应的反应速率总是大于吸热反应的反应速率 |
| C.应用盖斯定律,可以计 算某些难于直接测量的反应的反应热 |
| D.△H大 于零的反应是放热反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com