
【题目】实验室中所用少量氯气是用下列方法制取的,MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O,试回答下列问题:
MnCl2+Cl2↑+2H2O,试回答下列问题:
(1)该反应是氧化还原反应吗?__________(填“是”或“否”),如果是氧化还原反应,请指出__________是氧化剂,______________是还原剂,____________是氧化产物,______________是还原产物,根据上述氧化还原反应判断氧化性:__________>__________;还原性:__________>____________。
(2)写出该反应的离子方程式______________________________。
(3)用双线桥法标出该反应电子转移的方向和数目__________________________________。
【答案】是 MnO2 HCl Cl2 MnCl2 MnO2 Cl2 HCl MnCl2 4H++2Cl-+MnO2=Cl2↑+Mn2++2H2O 
【解析】
(1)依据化合价变化判断,元素化合价升高的物质作还原剂被氧化得到氧化产物;元素化合价降低的物质作氧化剂被还原发生还原反应,得到还原产物;氧化还原反应中的氧化剂的氧化性大于氧化产物,还原剂的还原性大于还原产物;
(2)依据化学方程式写出离子方程式;
(3)双线桥标注电子得失方向和数目.
(1)元素化合价升高的物质作还原剂被氧化得到氧化产物;元素化合价降低的物质作氧化剂被还原发生还原反应,得到还原产物;氧化还原反应中的氧化剂的氧化性大于氧化产物,还原剂的还原性大于还原产物;反应前后有元素化合价变化,说明是氧化还原反应;锰元素化合价从+4价变化为+2价,化合价降低作氧化剂被还原为还原产物氯化锰;氯化氢中氯元素化合价升高从-1价变化为0价,化合价升高作还原剂被氧化得到氧化产物Cl2,;氧化还原反应中氧化剂MnO2的氧化性大于氧化产物Cl2,还原剂HCl的还原性大于还原产物MnCl2;
故答案为:是;MnO2;HCl;Cl2;MnCl2;MnO2>Cl2;HCl>MnCl2;
(2)反应中二氧化锰难溶于水,反应的离子方程式为:4H++2Cl-+MnO2=Cl2↑+Mn2++2H2O;
(3)氧化还原反应中锰元素化合价从+4价降低到+2价;得到电子被还原;HCl中的氯元素化合价从-1价升高到0价失去电子被氧化;双线桥标注为: 。
。


科目:高中化学 来源: 题型:
【题目】根据下列实验操作和现象得出的结论正确的是( )
选项 | 实验操作 | 现象 | 结论 |
A | 将电石与水反应产生的气体通入酸性高锰酸钾溶液 | 溶液紫色褪去 | 证明有乙炔生成 |
B | 取CH3COONa溶液于试管中并加入几滴酚酞,再加热 | 溶液红色加深 | CH3COONa溶液显碱性且存在水解平衡 |
C | 向蔗糖溶液中加入稀硫酸,加热几分钟后加入新制Cu(OH)2悬浊液,加热煮沸 | 无红色沉淀生成 | 蔗糖没有发生水解反应生成葡萄糖 |
D | 向Na2S2O3溶液中滴加H2SO4溶液至过量 | 一段时间后溶液变浑浊 | Na2S2O3在该反应中只作氧化剂 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列转化的化学方程式,注明反应类型。
(1)甲苯→TNT ___________________
(2)乙烯→聚乙烯__________________
(3)1,3—丁二烯与氯气1,4—加成__________________
(4)溴乙烷和氢氧化钠的乙醇溶液共热___________________
(5)乙醇在铜催化下和氧气反应__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是![]()
![]()
A.煤的气化就是把煤转化为可燃性气体的过程。在高温下,煤和水蒸气作用得到CO、![]() 、
、![]() 等气体
等气体
B.糖类、油脂、蛋白质在一定条件下均能水解
C.向蛋白质溶液中加入饱和硫酸钠溶液,先产生白色沉淀,加水后又重新溶解
D.淀粉溶液中滴加硫酸,加热水解后,往水解液中滴加![]() 滴新制氢氧化铜,加热,无红色沉淀出现,原因可能是硫酸未完全被中和
滴新制氢氧化铜,加热,无红色沉淀出现,原因可能是硫酸未完全被中和
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种化合物,分别由K+、Ba2+、SO42—、CO32、OH—中的两种组成,它们具有下列性质:
①A不溶于水和盐酸;②B不溶于水,但溶于盐酸,并放出无色无刺激性气味的气体E;③C的水溶液呈碱性,与硫酸反应生成A;④D可溶于水,与硫酸作用时放出气体E,E可使澄清石灰水变浑浊。
(1)推断A、B、C、D的化学式。
A、________,B、________,C、________,D、________。
(2)写出下列反应的离子方程式。
B与盐酸反应:_______________________________________________,
C与硫酸反应:_______________________________________________,
E(少量)与澄清石灰水反应:____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以一种工业废渣![]() 主要成分为
主要成分为![]() 、
、![]() 和少量Fe、Cu的氧化物
和少量Fe、Cu的氧化物![]() 为原料制备
为原料制备![]() 实验过程如下:
实验过程如下:

![]() 酸溶过程中,
酸溶过程中,![]() 发生的化学方程式为______。
发生的化学方程式为______。
![]() 加入
加入![]() 的作用为______。
的作用为______。
![]() 下列关于分液漏斗及其使用方法的叙述,正确的是______
下列关于分液漏斗及其使用方法的叙述,正确的是______![]() 。
。
A 使用前要先检查玻璃塞和旋塞处是否漏液
B 将加入有机萃取剂后的混合液转移到分液漏斗中,塞上玻璃塞,用右手压住分液漏斗玻璃塞,左手握住旋塞,倒转漏斗,用力振荡,并不时旋开旋塞放气
C 分液时,必须塞紧上口玻璃塞,保证密封,以防止有机萃取剂挥发
D 本实验中,含![]() 的有机相一定从下口放出,水层从上口倒出
的有机相一定从下口放出,水层从上口倒出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某含有Na2O杂质的Na2O2试样,一个化学实验小组利用H2O与Na2O2的反应来测定该样品的纯度。可供选择的装置如下:
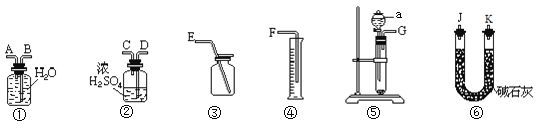
请回答下列问题:
(1)装置⑤中仪器a的名称是______。
(2)用上述装置可以组装一套最简单的测定过氧化钠样品纯度的实验装置。
Ⅰ.该实验装置的组合是________(填字母)。
a. ①④⑤ b. ①③⑤ c. ②④⑤ d. ③⑤⑥
Ⅱ.所选用装置的连接顺序应是__________(填各接口的字母,连接胶管省略)。
(3)写出实验中Na2O2发生反应的化学方程式_____________。
(4)用上述实验后所得溶液配制成浓度为1.0mol/L的溶液,回答下列问题。
①向400mL该溶液中通入0.3mol CO2,则所得溶液中HCO3–和CO32–的物质的量浓度之比约为___________。
A. 1:3 B. 1:2 C. 2:1 D. 3:1
②将上述溶液蒸发结晶得到Na2CO3和NaHCO3固体混合物,下列选项中不能准确测定混合物中Na2CO3质量分数的是____________。
a. 取a g混合物充分加热,在干燥器中冷却至室温,减重b g
b. 取a g混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b g固体
c. 取a g混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重b g
d. 取a g混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干,得b g固体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com